Повышение давления в пульмональной артерии является тяжелой патологией. Препараты для лечения легочной гипертензии включают несколько групп медикаментозных средств — антагонисты эндотелиновых рецепторов, ингибиторы ферментов, препятствующих расслаблению сосудов, простациклины, блокаторы кальциевых каналов, диуретики и ряд других лекарственных препаратов. Все их нужно применять только по рекомендации кардиолога и после тщательного, многостороннего обследования. Прием этих лекарств пожизненный, а улучшение наступает только спустя несколько месяцев.
Причины
Причины идиопатической гипертензии не известны. Из предполагающих факторов выделяют отягощенную наследственность, микротромбоэмболии (оседание кровяных сгустков) в сосудистом русле легочной ткани, дисфункцию эндотелия (внутренней выстилки) легочных капилляров.
Причинами вторичной легочной артериальной гипертензии служат такие заболевания, как:
- Кардиологические и сосудистые заболевания:
- постинфарктный кардиосклероз,
- постмиокардитический кардиосклероз – рубцовое замещение нормальной сердечной мышцы после ее воспаления,
- пороки сердца врожденного и приобретенного характера,
- опухоли сердечных тканей,
- артериальная гипертония,
- кардиомиопатии,
- тромбоэмболия легочной артерии,
- васкулиты – поражения сосудистой стенки воспалительного, аллергического или токсического характера.
- Болезни бронхо-легочной системы:
- хроническая обструктивная болезнь, характеризующаяся наличием хронического обструктивного бронхита и эмфиземы, чаще возникающих у длительно курящих пациентов,
- хронические бронхиты, бронхиолиты, пневмония с частым и затяжным течением,
- тяжелое течение бронхиальной астмы.
- Другие заболевания:
- поражения сосудистой стенки, обусловленные системными заболеваниями соединительной ткани – системной красной волчанкой, склеродермией и др,
- синдром портальной гипертензии с повышением давления в сосудах печени у лиц с циррозом печени,
- ВИЧ – инфекция,
- врожденные нарушения обмена веществ – патология щитовидной железы, гликогенозы (болезнь обмена гликогена в организме), гемоглобинопатии и др.
- Особое место занимает легочная гипертензия новорожденных, которая также может быть первичной или вторичной. Первый вариант развивается у новорожденного ребенка без признаков заболеваний легких. Второй вариант возникает у младенца при кардиологической или легочной патологии, а также при асфиксии (удушье) и гипоксии (кислородном голодании) в родах. Из причин, вызывающих персистирующую легочную гипертензию новорожденных, выделяют:
- респираторный дистресс – синдром (острые дыхательные нарушения),
- аспирация (вдыхание) меконием в родах,
- пневмонии и сепсис в периоде новорожденности,
- преждевременное (внутриутробное) закрытие открытого овального окна и артериального протока, предназначенных для “выключения” кровотока по легким у плода, и в норме закрывающихся в момент первого крика новорожденного или в первые месяцы жизни,
- врожденные диафрагмальные грыжи, при которых органы, расположенные в брюшной полости поджимают левое легкое, из-за чего кровоток правого легкого увеличен.
Острая форма гипертензии возникает в кратчайшие сроки и бывает обусловлена массивной тромбоэмболией легочной артерии, астматическим статусом, отеком легких.
Показания к употреблению антигипертензивных средств
Клиника патологии является неспецифической. Поэтому медикаментозную схему назначают только после проведения комплексного лабораторного и инструментального обследования пациента.
При легочной гипертензии возникает такая клиническая симптоматика, при которой показаны перечисленные медикаменты:
- Одышка. Она является постоянной и усиливается при физических и психоэмоциональных нагрузках. Возникает этот симптом даже при легкой степени гипертонии в дыхательной системе.
- Повышение систолического и диастолического артериального давления. Изменения в легочной системе провоцируют патологические процессы в сердечно-сосудистых органах.
- Болезненные ощущения в грудной клетке по типу стенокардии.
- Синкопальные состояния. Они являют собой кратковременные потери сознания на фоне изменения давления.
- Астенический синдром. Он включает постоянную усталость, слабость, звон в ушах и мелькание мушек перед глазами.
- Кровохарканье. Отделяемое при кашле часто содержит прожилки крови.
Симптомы заболевания
В связи с тем, что легочная гипертензия в большинстве случаев развивается медленно, клинические проявления на ранних стадиях могут отсутствовать длительное время.
По мере прогрессирования гипертензии наступает субкомпенсация заболевания, и появляются первые признаки заболевания. К ним относятся одышка, сначала обусловленная нагрузкой, а затем и в состоянии покоя. Кроме одышки, пациент отмечает синеватое окрашивание кожи лица и конечностей (акроцианоз), быструю утомляемость, общую слабость, снижение переносимости физических нагрузок. Возможны головокружения и обмороки вследствие снижения поступления кислорода к головному мозгу. Все эти симптомы являются проявлением начинающейся дыхательной недостаточности.
В связи с тем, что описанные симптомы встречаются при многих заболеваниях сердца, необходимо как можно скорее обратиться к врачу и уточнить причину появления таких признаков.
Вследствие постоянно высокого давления в капиллярах легких правый желудочек, функция которого сводится к проталкиванию крови в легочную артерию, не справляется с возросшей нагрузкой, и формируется правожелудочковая недостаточность. Признаками ее являются отеки сначала нижних конечностей, а затем и всего тела, увеличение живота, дискомфорт и болезненность в правой половине живота, обусловленные застоем жидкости в печени и ее увеличением вплоть до кардиального (сердечного) цирроза печени.
На стадии декомпенсации у пациента отмечается диффузный цианоз, распространенный по всему телу, выраженные отеки, одышка в покое и в положении лежа. Развиваются дистрофические изменения во всех органах и тканях.
В зависимости от анатомо-функциональных нарушений, возникающих при заболевании, а также от уровня переносимости физической нагрузки, выделяют степени гипертензии:
- 1 степень, или транзиторная (лабильная) – характеризуется непостоянным повышением давления в легочной артерии более 30 мм рт ст, возникающим после физических нагрузок. Как правило, симптомы беспокоят пациента при значительных нагрузках или не возникают совсем.
- 2 степень, или стабильная гипертензия – характеризуется постоянным повышением давления в легочной артерии выше 25 мм рт ст в состоянии покоя и выше 30 мм рт ст при нагрузках. Симптомы возникают при хорошо переносимой ранее нагрузке (ходьба пешком, подъем по лестнице и т. д.).
- 3 степень, или необратимая – развивается правожелудочковая недостаточность со всеми ее клиническими проявлениями, в отсутствие лечения быстро прогрессирующая до терминальной стадии и летального исхода.
Как предупредить и прогнозы?
Маскировка заболевания под другие является проблемой даже для знатоков лечебного дела. Часто больных лечат по неправильным диагнозам, поэтому в будущем необходимо развивать диагностику недуга во избежание летальных исходов. Стоит повышать выживаемость пациентов. Врачи не теряют надежду выяснить, почему под угрозой лица именно молодого и среднего возрастов.
Нужно создавать региональные центры, позволить исследовать заболевание высококвалифицированным специалистам разных стран ради своевременной помощи больным легочной гипертензией и открытия профилактических средств. Эта патология по частоте заболеваемости занимает 3-е место после инфаркта миокарда и инсульта. Эти цифры побуждают врачей вплотную заняться этим вопросом, ведь заболевание, что приносит столько жертв, необходимо лечить.
Говоря о прогнозах, то зависят они от тяжести течения и формы недуга. Наиболее опасная первичная ХТЛГ. Выживаемость в первый год болезни ― 68%, а через 5 лет ― 30%. При стабильно высоком давлении в легочных сосудах и положительном отклике на лечение, то исход благоприятен. На декомпенсированной стадии (конечный этап прогрессирования недуга) выживаемость составляет не более 5-ти лет.
Предотвратить хроническую тромбоэмболическую легочную гипертензию можно, если вести здоровый образ жизни, отказаться от вредных привычек, стрессов и значительных физических нагрузок. Лицам, больным патологиями, что провоцируют повышенное тромбообразование важно проводить тромболитическую терапию. При достаточном и своевременно начатом лечении прогноз для жизни и трудовой деятельности благоприятный, однако полностью излечить патологию без оперативного вмешательства невозможно.
- Профилактика заболеваний органов дыхания
- Пневмония у детей — причины, симптомы, диагностика и лечение
Диагностика
В связи с тем, что легочная гипертензия может прогрессировать до тяжелой правожелудочковой недостаточности довольно быстро (уже через 2-8 лет от момента установления диагноза), необходимо настороженно относиться в плане подозрения на гипертензию у лиц с имеющимися заболеваниями сердца и легких, а также с системными заболеваниями.
Для этого указанной категории пациентов необходимо регулярно посещать лечащего врача с ежегодным проведением следующих методов обследования:
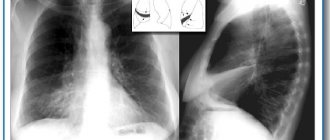
- Рентгенография грудной клетки позволяет определить увеличение границ сердца при гипертрофии правого желудочка и усиление легочного рисунка за счет сосудистого компонента,
- ЭКГ кроме признаков основной патологии (ишемия миокарда, постинфарктный кардиосклероз и др), позволяет выявить признаки гипертрофии правого желудочка и перегрузку правых отделов сердца,
- Эхокардиография помогает не только диагностировать заболевания миокарда, но и косвенно измерить давление в легочной артерии, на основании чего решается вопрос о проведении инвазивного метода диагностики – катетеризации легочной артерии с более точным измерением давления в ней.
легочная гипертензия на рентгеновском снимке
Для уточнения диагноза при подозрении на гипертензию вследствие тромбоэмболии мелких ветвей легочной артерии показаны такие методы, как:
- Радионуклидное сканирование легких, основанное на способности меченых радиоизотопами атомов проникать в кровь, в результате чего излучение от этих атомов улавливается соответствующим экраном и получается картина, воссоздающая ток крови в легких,
- Легочная ангиография – введение контрастного вещества в легочную артерию с последующими рентгеновскими снимками,
- Компьютерная томография легких.
Для своевременной диагностики заболевания достаточно первых трех методов обследования, проводимых регулярно, не реже одного раза в год, а по показаниям и чаще.
У новорожденных детей гипертензию также можно установить при проведении УЗИ сердца и рентгенографии.
Список лекарств от гипертонии — названия, описания препаратов
Здесь приводится список лекарств от гипертонии, их фармацевтические и «коммерческие» названия. Эта страница упросит поиск информации об интересующих вас препаратах. Чтобы быстро найти нужное вам лекарство, воспользуйтесь поиском «найти на странице» в вашей программе просмотра интернет-сайтов.
Подробную информацию о лекарствах (показания к применению, дозировку, побочные эффекты, совместимость с другими лекарствами) – см. в отдельных статьях, ссылки на которые приводятся здесь.
Мочегонные лекарства от гипертонии: подробный список
Гипертензия легочной артерии формируется на фоне других болезней, у которых могут быть совершенно разные причины возникновения. Развивается гипертензия в связи с разрастанием внутреннего слоя легочных сосудов. При этом происходит сужение их просвета и сбои в кровоснабжении легких.
Болезнь эта довольно редкая, но, как это ни печально, большинство случаев заканчивается летальным исходом.
К основным заболеваниям, которые приводят к развитию это патологии, относятся:
- хронический бронхит;
- фиброз ткани легких;
- врожденные пороки сердца;
- бронхоэктаз;
- гипертония, кардиомиопатия, тахикардия, ишемия;
- тромбозы сосудов в легких;
- альвеолярная гипоксия;
- повышенный уровень эритроцитов;
- спазмы сосудов.
Существует также ряд факторов, которые способствуют возникновению легочной гипертензии:
- болезни щитовидной железы;
- интоксикация организма ядовитыми веществами;
- длительный прием антидепрессантов или препаратов, угнетающих аппетит;
- употребление наркотических веществ, принимаемых интраназальным путем (вдыханием через нос);
- ВИЧ-инфекции;
- онкологические заболевания кровеносной системы;
- цирроз печени;
- генетическая предрасположенность.
Легочная гипертензия может сформироваться в результате продолжительного сдавливания сосудов легких. Такое состояние может возникнуть при травмах грудной клетки, избыточном весе и при опухолях.
Лечение легочной гипертензии
Терапия гипертензии должна быть начата безотлагательно, как только диагноз подтвердился, даже если присутствуют лишь незначительные симптомы. Лечение в первую очередь должно быть направлено на устранение основного заболевания. Из препаратов, хорошо себя зарекомендовавших в процессе клинических исследований, и являющихся препаратами первого ряда в лечении легочной гипертензии, показаны:
- Антагонисты кальциевых каналов – нифедипин, амлодипин, дилтиазем. Предпочтительнее назначать ретардные формы, оказывающие более продолжительный эффект.
- Препараты, называемые простаноидами, оказывают мощный расслабляющий эффект на сосудистую стенку. Такие препараты, как эпопростенол и трепростинил применяются в виде инъекций, причем для достижения эффекта применять их следует длительно, что не совсем удобно и не дешево для пациента. Поэтому в последние годы был разработан илопрост, применяющийся ингаляционно в виде аэрозоля, и обладающий доказанной клинической эффективностью.
- Антагонисты эндотелиновых рецепторов препятствуют ремоделированию и изменению эластичности сосудистой стенки легочных артерий. Одним из наиболее изученных препаратов является бозентан в виде таблетированных форм.
Кроме перечисленных, обязательны лекарства для лечения основного кардиологического (диуретики, антигипертензивные препараты, нитраты при ишемии миокарда и т. д) или бронхолегочного заболевания (своевременная антибиотикотерапия, ингаляционные препараты для лечения бронхиальной астмы и т. д.).
У новорожденных детей для лечения легочной гипертензии в первые дни жизни применяется кислородотерапия через маску или с помощью искусственной вентиляции легких, а также подача смеси кислорода с оксидом азота, оказывающим расслабляющее действие на сосуды легких и, следовательно, снижающим нагрузку на сердце ребенка. В последние годы значительных успехов достигает применение экстракорпоральной мембранной оксигенации крови ребенка, при которой забираемая с помощью аппарата кровь насыщается кислородом через специальный контур, а затем возвращается в кровеносное русло.
Кроме медикаментозного, по показаниям назначается хирургическое лечение, например, при пороках сердца, тромбоэмболии легочной артерии, значительной окклюзии коронарных артерий, вызвавшей инфаркт миокарда и т. д.
Купить онлайн
Эпидемиология. Патогенез
Одним из важнейших направлений научных работ Е.И. Чазова было изучение тромбозов и эмболий, в частности тромбоэмболии легочной артерии (ТЭЛА). В монографии «Очерки неотложной кардиологии» [1] Е.И. Чазов точно описывает картину этой болезни, используя яркие клинические примеры, определяет сложности дифференциальной диагностики ТЭЛА.
В книге «Тромбозы и эмболии в клинике внутренних болезней» [2] Е.И. Чазов определяет тромбозы и эмболии легочной артерии как одну из актуальных проблем терапевтической клиники.
В работе приводятся эпидемиологические данные по ТЭЛА, описываются ее клиника и диагностика, упоминаются возможные механизмы развития болезни.
В монографии также ставится вопрос о связи ТЭЛА и хронической тромбоэмболической легочной гипертензии (ХТЭЛГ): «В последнее время многие авторы интенсивно изучают проблемы возникновения легочного сердца и гипертонии малого круга кровообращения. Появляются сообщения, что подобные состояния могут развиваться как хронический процесс в результате повторных эмболий или тромбозов в мелких ветвях легочной артерии. Возникает даже предположение, что этот процесс оказывает значительное влияние на возникновение и течение болезни Аэрца, одним из характерных симптомов которого является гипертония малого круга кровообращения… Мы полагаем, что тромбоэмболии мелких ветвей легочной артерии имеют известное значение для развития первичной легочной гипертонии, однако этот вопрос требует дальнейшего исследования».
Сейчас многие предположения и суждения, высказанные более 40 лет тому назад Е.И. Чазовым, представляются упрощенными. Но тот фундамент, который был заложен в этих работах, послужил основой дальнейших исследований в данном направлении.
Работы по ХТЭЛГ активно продолжаются в НИИ клинической кардиологии им. А.Л. Мясникова ФГБУ НМИЦ кардиологии МЗ РФ.
Далее приводится современное представление о ХТЭЛГ, ее эпидемиологии, патогенезе, диагностике и основных подходах к лечению.
ХТЭЛГ — прекапиллярная форма легочной гипертензии (ЛГ), которая согласно современной классификации наряду с другими обструкциями легочной артерии (опухоли, сосудистые аномалии, эмболы) относится к IV группе ЛГ [3].
Точных эпидемиологических данных о распространенности ХТЭЛГ как в нашей стране, так и в мире в настоящее время нет. Среди всех форм ЛГ форма ХТЭЛГ встречается в 1,5—3% случаев [3]. Уникальность ХТЭЛГ в том, что она является потенциально излечимой формой ЛГ, поскольку имеет хороший функциональный и гемодинамический эффект при своевременном и успешно проведенном хирургическом лечении.
Принято считать, что чаще всего ХТЭЛГ представляет собой позднее осложнение острой ТЭЛА. По данным международного исследования, у 75% пациентов с ХТЭЛГ имел место в анамнезе как минимум один эпизод зарегистрированной ТЭЛА [4]. В 56% случаев причиной острой ТЭЛА послужил тромбоз глубоких вен нижних конечностей [5]. В 50% случаев после перенесенной острой ТЭЛА, на фоне адекватной антикоагулянтной терапии полного лизирования тромботических масс не происходит, это подтверждается данными сцинтиграфии легких, демонстрирующими наличие стойких дефектов перфузии [6]. Однако лишь у 0,1—9,1% пациентов в течение первых двух лет после эпизода перенесенной острой ТЭЛА развивается ХТЭЛГ [7—10].
Обструкция ветвей легочной артерии тромботическими массами и вторичные изменения микроциркуляторного русла легких приводят к повышению легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА), что в свою очередь способствует развитию тяжелой дисфункции правых отделов сердца с формированием на начальных этапах изолированной правожелудочковой сердечной недостаточности, а при запущенном течении заболевания — бивентрикулярной сердечной недостаточности, которая и определяет крайне неблагоприятный прогноз у этой категории больных [11].
В большинстве исследований переоценивается встречаемость ХТЭЛГ после перенесенного эпизода острой ТЭЛА. Одной из причин такой переоценки является то, что многие пациенты на момент впервые диагностированного эпизода ТЭЛА уже имели ХТЭЛГ. Также в большинстве исследований ХТЭЛГ была диагностирована спустя несколько месяцев после эпизода острой ТЭЛА, что не характерно для данного заболевания, поскольку, как правило, ХТЭЛГ развивается после так называемого светлого промежутка — периода бессимптомного течения заболевания, который чаще всего длится несколько лет. Так, в исследовании L. Guérin и соавт. [12], в которое были включены 146 пациентов с диагнозом острой ТЭЛА, за время наблюдения (26 мес) у 8 была заподозрена ХТЭЛГ в связи с появлением типичных симптомов и эхокардиографических признаков. После проведения катетеризации правых отделов сердца (КПОС) диагноз был подтвержден у 7 (4,8%) из 8 пациентов. Однако во время зарегистрированного первого эпизода острой ТЭЛА только у 2 пациентов систолическое давление в легочной артерии (СДЛА) составило ниже 50 мм рт.ст., в остальных 5 случаях СДЛА — от 62 до 102 мм рт.ст., что нехарактерно для первого эпизода ТЭЛА. Это связано с тем, что неадаптированный правый желудочек, в силу своих анатомо-физиологических особенностей, не может справиться с остро возникшим повышением легочного давления выше 50 мм рт.ст. Поэтому, по мнению авторов, вероятно, ХТЭЛГ присутствовала у этих больных и ранее. Таким образом, частота ХТЭЛГ после перенесенного острого эпизода ТЭЛА в исследовании L. Guerin и соавт. была не более 1,5%.
Согласно Европейскому регистру ХТЭЛГ в среднем от момента появления первых признаков заболевания до постановки диагноза проходит 1 год. В первую очередь это связано с неспецифичностью первых признаков заболевания: развивающаяся у пациента одышка, снижение толерантности к физическим нагрузкам могут быть проявлениями большого количества заболеваний, а отсутствие настороженности врачей первого звена приводят к задержке в постановке правильного диагноза.
На сегодняшний день существует немалое количество теорий, пытающихся объяснить причину неполного лизирования тромботических масс, однако ни одна из них не может полностью раскрыть патогенез данного процесса [13, 14].
Известно, что при развитии определенных клинических состояний наблюдается повышение активности тромбоцитов, что в свою очередь предрасполагает к патологическому тромбообразованию и формированию ХТЭЛГ. При сравнении 433 пациентов с ХТЭЛГ и 254 пациентов с другими формами ЛГ, такими как наличие внутрисердечных шунтов, инфицированные кардиостимуляторы, спленэктомия, предшествующий тромбоз вен нижних конечностей (особенно рецидивирующее течение), не 0 (I) группа крови, наличие волчаночного антикоагулянта/антифосфолипидных антител, заместительная гормональная терапия щитовидной железы и наличие в анамнезе злокачественных новообразований, а также аутоиммунные заболевания и заболевания крови врожденного и приобретенного характера, были обозначены как факторы, повышающие риск развития ХТЭЛГ [15—17]. Также по результатам нескольких исследований было высказано предположение, что при эмболии крупными тромбоэмболами, при рецидивирующей ТЭЛА происходит истощение физиологической фибринолитической системы, ее активности не хватает для полного лизирования сгустков [10, 18]. Такая своего рода неполноценность физиологической фибринолитической системы вызывает подозрение в отношении наличия врожденной склонности к гиперкоагуляционным состояниям вследствие врожденной патологии системы гемостаза. Однако известно, что такие классические тромбофилии, как дефицит протеина С, S и дефицит антитромбина III, а также мутации фактора V и II, у пациентов с ХТЭЛГ встречаются не чаще, чем в здоровой популяции [17]. Лишь повышенный уровень антифосфолипидных антител и волчаночного антикоагулянта были зарегистрированы у пациентов с ХТЭЛГ чаще, чем у пациентов с идиопатической ЛАГ. По данным других исследований, у 41% пациентов с ХТЭЛГ наблюдались повышенные уровни фактора свертывания VIII, фактора фон Виллебранда, адгезивного гликопротеина, который стабилизирует и активирует фактор VIII [19]. Также при ХТЭЛГ, по-видимому, имеют место аномалии в строении молекул фибриногена [20—22], сопровождающиеся модификацией структуры фибрина и самого сгустка, что проявляется резистентностью к физиологическому тромболизису и, таким образом, замедляет процесс разрешения тромботических масс. В исследовании, в котором проводилось сравнение фибриногена больных ХТЭЛГ со здоровой группой контроля, было показано, что фибриноген больных ХТЭЛГ более резистентен к плазминопосредованному лизису. Исследователи предположили, что это связано с измененной структурой фибрина и/или фибриногена. Помимо этого, измененная структура фибриногена была обнаружена и в сосудистой стенке легочной артерии, что, по мнению авторов, может влиять на переход острой ТЭЛА в ХЭТЛГ [22]. Еще в одном исследовании изучалась роль активируемого тромбином ингибитора фибринолиза. Уровень данного показателя был значительно повышен у пациентов с ХТЭЛГ, чем у больных легочной артериальной гипертензией и группой контроля, и коррелировал с резистентностью тромба к лизису, что демонстрирует значительную роль этого показателя в патогенезе заболевания [23].
Наряду с вышеперечисленным еще одним ключевым механизмом в разрешении тромботических масс является неоангиогенез. В образцах сгустков, полученных после тромбэндартерэктомии (ТЭЭ), было обнаружено, что ангиогенез у пациентов с ХТЭЛГ был неполноценным, что также было доказано на экспериментальных моделях [24, 25].
Эндотелиальная дисфункция и ремоделирование сосудов малого круга кровообращения при ХТЭЛГ
Механическая окклюзия легочной артерии тромботическими массами — это не единственный механизм формирования ЛГ при ХТЭЛГ. У всех пациентов с ХТЭЛГ имеет место в разной степени выраженная микроваскулопатия, которая представляет собой своего рода диффузный спазм дистального легочного русла с диаметром артерии около 0,1—0,5 мм вследствие высвобождения из тромбоцитов и эндотелия вазоконстрикторных и прокоагуляционных веществ [3]. Впервые данная патология была описана K. Мoser и C. Bloor при изучении гистологических образцов легочной ткани больных Л.Г. Исследователи наблюдали утолщение интимы и ремоделирование сосудов малого круга кровообращения в виде эксцентрического фиброза интимы, фиброзно-мышечной пролиферации интимы и плексиформные поражения [26, 27]. Такое же поражение было замечено ранее у пациентов с идиопатической ЛАГ, что и послужило основанием для использования препаратов, одобренных для лечения идиопатической ЛАГ при ХТЭЛГ.
В литературе такие изменения объясняются как результат перераспределения легочного кровотока между непораженными тромбами легочными артериями. Под действием непривычно высокого давления и напряжения возникают эндотелиальная дисфункция и ремоделирование сосудов малого круга кровообращения, что приводит к прогрессированию заболевания, постепенному увеличению ДЛА и ЛСС. Тем не менее эта микроваскулопатия наблюдается не только в непораженных областях легкого, но и в дистальных сегментах окклюзированных артерий, что нельзя объяснить простым перераспределением кровотока. В исследовании Р. Dorfmüller и соавт. [28] обнаружили, что у пациентов с ЛГ существуют анастомозы между системным и легочным кругами кровообращения (через бронхиальные артерии). Исследователи предположили, что данный вид компенсации формируется для поддержания перфузии в ишемизированном участке (зона кровоснабжения тромбированной легочной артерии), а как было указано выше, воздействие высокого системного артериального давления на легочное сосудистое русло приводит к эндотелиальной дисфункции и ремоделированию сосудов малого круга кровообращения. Продолжающееся ремоделирование сосудов малого круга кровообращения в конечном счете может привести к тромбообразованию in situ
[29].
Чаще всего тяжелое диффузное дистальное поражение легочного русла подозревается, когда степень механической непроходимости легочных артерий не соотносится с показателями ЛСС [30]. Такие больные имеют более высокий риск периоперационных и послеоперационных осложнений при проведении ТЭЭ из ветвей легочной артерии и большую вероятность сохранения резидуальной ЛГ [31—33].
Известно, что развитие выраженной микроваскулопатии ограничивает эффективность не только хирургического лечения, но также и эндоваскулярного лечения методом транслюминальной баллонной ангиопластики легочных артерий (ТЛА).
Таким образом, для возможности контроля за течением заболевания необходимо выявлять и лечить ХТЭЛГ до развития необратимого ремоделирования дистального легочного русла.
Диагностика ХТЭЛГ
Для определения тактики лечения в первую очередь необходима правильная, своевременная диагностика [3] (рис. 1).
Рис. 1. Диагностический алгоритм при подозрении на наличие ХТЭЛГ.
Диагноз ХЭТЛГ устанавливается при выявлении следующих показателей, полученных как минимум через 3 мес после начала оптимальной антикоагулянтной терапии, если:
1. Среднее давление в легочной артерии 25 мм рт.ст. и выше при давлении заклинивания в легочной артерии (ДЗЛА) 15 мм рт.ст. и ниже.
2. Легочное сосудистое сопротивление более 2 Ед. Вуда (160 дин. с/см5).
3. Как минимум один сегментарный дефект перфузии по данным вентиляционно-перфузионной сцинтиграфии легких или обструкция ветвей легочной артерии по данным мультиспиральной компьютерной томографии ангиографии или инвазивной ангиопульмонографии, которая является «золотым стандартом» визуализации легочного артериального русла [3].
Характерными для ХТЭЛГ являются поражения легочных артерий в виде хронических окклюзий (мешотчатые и клиновидные поражения), кольцевидных стенозов, внутрисосудистых структур в виде мембран и перемычек. В зависимости от патологических изменений в легочном сосудистом русле поражение можно разделить на проксимальный тип — технически операбельная форма ХТЭЛГ, и дистальный тип — поражение на сегментарном уровне и микроваскулярное поражение, которые считаются неоперабельными [3].
Помимо преимущественной локализации тромботических масс в легочном сосудистом русле при определении операбельности пациента, чрезвычайно важным являются показатели центральной гемодинамики. Известно, что при ЛСС более 1200 дин. с/см5 операция двусторонней ТЭЭ сопровождается большей частотой осложнений и имеет более высокий риск летальности [30].
Оценка операбельности пациента должна проводиться в экспертном центре мультидисциплинарной комиссией с обязательным участием кардиолога, сердечно-сосудистого хирурга, имеющего опыт проведения операций ТЭЭ, и специалиста по рентгенэндоваскулярной диагностике и лечению [3].
Молекулярные механизмы развития ХТЭЛГ. Точки воздействия патогенетической терапии
При изучении молекулярных механизмов развития ЛГ при ХТЭЛГ выявлено, что дефицит оксида азота (NO), простациклина, а также повышенная продукция эндотелина-1 являются основными звеньями патогенеза заболевания [31]. По результатам исследований одним из важных на сегодняшний день видится путь NO [34, 35]. Эндогенный NO образуется из L-аргинина при помощи кальций-зависимой NO-синтазы, под действием которой происходит окисление L-аргинина до L-цитруллина, NO и воды [36]. В здоровом организме NO играет ключевую роль в поддержании вентиляционно-перфузионного соотношения в легких за счет снижения уровня NO в областях с низкой вентиляцией, что приводит к вазоконстрикции и увеличению уровня NO в областях с повышенной вентиляцией, что приводит к вазодилатации. В конечном счете перераспределение кровотока в хорошо вентилируемые участки легкого обеспечивает эффективную оксигенацию. Известно, что NO регулирует расширение легочных сосудов, активируя растворимую гуанилатциклазу в гладкомышечных клетках артерий и повышая уровень цГМФ, приводит к снижению тонуса сосудов. Помимо этого, цГМФ обладает антипролиферативными и антифиброзирующими эффектами [37].
Несмотря на достигнутые в лечении ЛГ успехи, применение аналогов простациклина, антагонистов рецептора эндотелина, ингибиторов фосфодиэстеразы (ИФЭС) 5-го типа и их комбинаций не позволило в полной мере контролировать течение заболевания, а применение вдыхаемого NO и его донаторов было малоэффективным для долгосрочной терапии ввиду быстрого разрушения и развития толерантности. Вот почему необходимость в селективном, не зависящем от уровня NO вазодилататоре была так очевидна.
ИФЭС 5-го типа силденафил увеличивает эффекты эндогенного NO, повышая уровни цГМФ, однако большая часть пациентов с ЛГ не реагируют на лечение силденафилом в связи с крайне низким уровнем эндогенного NO, который на таком уровне не может повлиять на цГМФ в достаточной степени [38].
Прямая NO-независимая стимуляция рГЦ была впервые продемонстрирована в 1994 г., когда F. Ko и соавт. сообщили о цГМФ-стимулирующих свойствах бензилиндазола YC-1. В последующем были разработаны более эффективные два класса стимуляторов цГМФ: стимуляторы гуанилатциклазы или гем-зависимые активаторы (BAY 41−2272, BAY 41−8543, BAY 63−2521, риоцигуат) с пиразолопиридинилпиримидиновым ядром и стимуляторы гуанилатциклазы или гем-независимые активаторы (BAY 58−2667, цинацигуат, HMR-1766, атацигуат) [39, 40]. Каждый из указанных классов лекарственных препаратов продемонстрировал позитивные эффекты на экспериментальных моделях ЛГ, однако различные фармакокинетические эффекты, например ингибирование и индукция изоферментов цитохрома P450, не позволили BAY 41−2272 и BAY 41−8543 пройти доклинические испытания. В настоящее время для пациентов с неоперабельной формой ХТЭЛГ существует доказанная эффективная медикаментозная терапия. Препарат выбора риоцигуат повышает биосинтез цГМФ посредством прямой стимуляции и путем повышения чувствительности фермента в условиях низких концентраций эндогенного NO [41]. Наличие двойного действия в стимуляции рГЦ сделало риоцигуат более эффективным по сравнению с ИФДЭ-5. Другие классы препаратов, такие как ИФДЭ-5, антагонисты рецептора эндотелина и простаноиды, упоминаются в действующих рекомендациях с классом IIb [33]. В табл. 1 указан
Таблица 1. Исследования, посвященные изучению эффективности патогенетической терапии при ХТЭЛГ Примечание. ФК — функциональный класс; СИ — сердечный индекс; СВ — сердечный выброс. список исследований, посвященных изучению эффективности патогенетической терапии при ХТЭЛГ [42].
Современные методы лечения ХТЭЛГ
С начала 60-х годов ХХ века и по сегодняшний день «золотым стандартом» лечения ХТЭЛГ остается операция двусторонней ТЭЭ, которая при успешном выполнении, помимо нормализации гемодинамических параметров и улучшения функционального статуса, позволяет обеспечить 5-летнюю выживаемость на уровне 74—89% [42, 43]. По данным J. Lewczuk и соавт., 2-летняя выживаемость больных с ХТЭЛГ при срДЛА более 30 мм рт.ст., при отсутствии хирургического лечения составляет 12% [44].
Учитывая технические особенности операции, показатель смертности в центре, где проводятся подобного рода вмешательства, не должен превышать 5% [43, 45]. К сожалению, не только недостаточные оснащенность и профессионализм специалистов центра являются ограничениями для проведения оперативного лечения. По данным международного регистра, только 63% пациентов с ХТЭЛГ признаются операбельными [46], оставшиеся 37% по решению междисциплинарной комиссии имеют неоперабельную форму, чаще всего к ним относят больных с дистальным типом поражения легочных сосудов, а также с тяжелой сопутствующей патологией [47, 48].
Высокий уровень смертности больных с ХТЭЛГ, признанных неоперабельными, и стремительное развитие эндоваскулярных методов лечения привели к появлению нового альтернативного метода лечения ХТЭЛГ — ТЛА. В 1988 г. Voorburg и соавт. впервые доложили об эффективном эндоваскулярном вмешательстве на легочных артериях у больного 30 лет с ХТЭЛГ. После поэтапной ангиопластики легочных артерий отмечалось снижение срДЛА с 46 до 35 мм рт.ст. В последующем к данном методу лечения вернулись лишь в 2001 г. Feinstein и соавт. Исследователи продемонстрировали хорошие результаты в улучшении гемодинамических параметров и функционального статуса у 18 пациентов с ХТЭЛГ. Однако количество жизнеугрожающих осложнений, таких как реперфузионный отек легких, который развился у 11 из 18 больных, и перфорация легочной артерии, приведшая к летальному исходу, не позволили методу на тот момент внедриться в повседневную клиническую практику. Спустя 10 лет японские ученые возродили данный метод лечения, усовершенствовав технику выполнения процедуры, разработав целый алгоритм подготовки больных перед эндоваскулярным лечением [49—51].
С 2020 г. Европейским обществом кардиологов и Европейским респираторным обществом ТЛА при дистальном типе поражения введена в структуру алгоритма лечения ХТЭЛГ с классом рекомендаций IIb. На сегодняшний день во всем мире ежегодно выполняется большое количество эндоваскулярных вмешательств на легочных артериях. Список наиболее крупных исследований в период с 2001 по 2020 г. представлен в табл. 2 [52].
Таблица 2. Список наиболее крупных исследований по изучению ТЛА
Согласно данным литературы, количество периоперационных и послеоперационных осложнений при выполнении ТЛА в среднем составляет 10—52% [53]. Такое относительно немалое количество осложнений объясняется особенностью строения сосудистой стенки легочной артерии. Более тонкая и более растяжимая легочная артерия при неаккуратном манипулировании катетером или баллоном может перфорироваться, привести к реперфузионному отеку.
При анализе всех опубликованных на сегодняшний день результатов, 30-дневная смертность больных, прошедших процедуру ТЛА, составила от 0 до 14,3% [52]. Отдаленные результаты шести исследований показали, что показатели 2-летней выживаемости пациентов после ТЛА составили от 89 до 100%. По данным того же обзора, 2-летняя смертность пациентов, прошедших ТЛА, и пациентов на медикаментозной терапии составила 1,3% против 13,2% соответственно, при этом не было значительной разницы в 2-летней смертности пациентов, прошедших ТЛА и ТЭЭ (2,1% против 4,8% соответственно) [54, 55].
При изучении всех возникших при проведении ТЛА осложнений обнаружено, что кровоизлияния в паренхиму легких возникли в 17,8%, кровохарканье — в 14,0%, перфорация легочной артерии — в 2,9%. В 5,5% случаев пациенты нуждались в проведении инвазивной вентиляции легких [56—64].
По результатам многоцентрового ретроспективного анализа данных ТЛА в 7 лечебных учреждениях Японии (308 пациентов, 1408 сессий, в среднем одному пациенту было выполнено 4 вмешательства) гемодинамические показатели значительно улучшились у 249 пациентов [65]. По данным КПОС, достигнутые результаты сохранялись без отрицательной динамики и в отдаленном периоде (до ТЛА срДЛА составило 43,2±11,0 мм рт.ст., после последней процедуры ТЛА — 24,3±6,4 мм рт.ст., в отдаленном периоде — 22,5±5,4 мм рт.ст.). В большинстве отчетов по ТЛА, в которые были включены более 10 пациентов, указывается, что в среднем показатели срДЛА снижаются на 10—20 мм рт.ст. от исходного уровня после проведения 4—5 процедур ТЛА. Нельзя не отметить тот факт, что все пациенты получали как минимум один патогенетический препарат и терапию кислородом [65].
Уменьшить количество наиболее частого осложнения — реперфузионного отека легких — удалось после разработки индекса PEPSI (Pulmonary Edema Predictive Scoring Index), расчет которого позволяет оценить риск реперфузионного отека в зависимости от количества открытых сосудов и степени улучшения кровотока по ним [67]. Индекс PEPSI является произведением исходного уровня ЛСС в единицах Вуда (дин·с/см5/80) и степени ожидаемого прироста кровотока после ангиопластики каждой сегментарной артерии. Для обеспечения максимальной безопасности при каждом вмешательстве значение индекса PEPSI не должно превышать 35. Степень прироста кровотока (∆PFG) аналогична оценке TIMI в коронарных артериях.
Согласно публикациям зарубежных исследователей, процедура ТЛА проводится чаще через бедренную вену. В России в ФГБУ НМИЦ кардиологии после разработки Н.М. Даниловым и соавт. [66] доступа через поверхностные вены предплечья для проведения диагностической КПОС и ТЛА используется только данный доступ. Важным преимуществом нового доступа является возможность проведения вмешательства при посттромбофлебитическом синдроме, установленном кава-фильтре и клипированной нижней полой вене.
За последние 5 лет в стратегии и технике проведения ТЛА произошла эволюция. Так, например, ранее японскими авторами рекомендовалось при выполнении процедуры для первого баллонирования использовать баллон, соответствующий размеру легочной артерии, что часто вызывало надрыв интимы легочной артерии с последующими осложнениями в виде кровохарканья. В настоящее время показано, что кровоток в достаточной степени восстанавливается после применения баллонов меньшего диаметра по сравнению с должным диаметром артерии [68]. Наряду с этим было показано, что диаметр баллонированного сосуда дополнительно увеличивается с течением времени и в конечном счете градиент давления по обе стороны от пораженного участка выравнивается [69].
Считается, что для повышения эффективности и безопасности ТЛА необходимо выбрать оптимальный субстрат (артерию), на котором будет проводиться вмешательство. Для этого была разработана ангиографическая классификация типов поражения легочных артерий (рис. 2)
Рис. 2. Ангиографическая классификация по типу поражений легочных артерий. Тип A — кольцеобразное поражение; тип B — поражение по типу сети; тип C — субтотальное поражение; тип D — тотальная окклюзия; тип E — выраженное дистальное поражение. [64].
При изучении типов и характера поражения легочных артерий по данным инвазивной ангиопульмонографии и МСКТ-ангиопульмонографии выяснилось, что частота осложнений и частота успеха от вмешательства напрямую зависит от типа поражения выбранного целевого сосуда. Эффективность была выше, а уровень осложнений был ниже при типах поражения, А и В (кольцеобразное поражение и поражение по типу сети). Ангиопластика тотально окклюзированных сосудов имела наименьший успех, а наибольшее количество осложнений развивалось при лечении субтотального поражения [64].
По мере накопления опыта расширяются и области применения ТЛА. Метод стал применяться у пациентов с резидуальной ЛГ, а также у больных с комбинированным поражением легочных сосудов (проксимальный и дистальный типы поражения легочных артерий). В практику уверенно входит гибридный подход лечения неоперабельной ХТЭЛГ, при котором оперативному лечению предшествует серия ТЛА до необходимого для хирургического вмешательства улучшения гемодинамических показателей. Дополнительными показаниями к ТЛА могут быть неэффективность или невозможность назначения патогенетической медикаментозной терапии. Противопоказаниями к ТЛА служит перечень состояний и сопутствующих заболеваний, лимитирующих любое эндоваскулярное вмешательство с использованием контрастных препаратов (тяжелая почечная недостаточность, аллергия на контрастный препарат, анемия, острый воспалительный процесс и др.). Следует подчеркнуть, что тяжелая ЛГ, высокое ЛСС, гипоксемия и сниженный сердечный выброс не являются противопоказаниями, а скорее делают ТЛА методом выбора [70].
Есть немногочисленные данные, сравнивающие различные методы лечения ХТЭЛГ: лекарственную терапию, ТЛА, ТЭЭ. Несмотря на изначально худшие показатели гемодинамики у пациентов, подвергшихся ТЭЭ или ТЛА, по результатам исследования больные имели значительно более высокую выживаемость в течение 5 лет, чем больные, получавшие только медикаментозную терапию (98% против 64% соответственно) [68].
В табл. 3 представлены
Таблица 3. Основные исследования, в которых сравнивали 3 метода лечения ХТЭЛГ основные исследования, в которых сравнивали 3 метода лечения ХТЭЛГ [52].
В дополнение к улучшениям в гемодинамике и функциональном статусе на сегодняшний день накоплены данные, указывающие, что ТЛА способствует обратному ремоделированию правых отделов сердца [71].
Таким образом, борьба с последствиями сосудистого тромбоза в малом круге кровообращения продолжается, появляются новые методы лечения и совершенствуются старые. Направление усилий по борьбе с ХТЭЛГ, более четкое понимание механизмов развития данного заболевания, заложенные Евгением Ивановичем Чазовым, позволяют всерьез надеяться на успех в сражении с грозным заболеванием.
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Чазова Ирина Евгеньевна
— Заместитель Генерального директора, директор института клинической кардиологии им. А.Л. Мясникова ФГБУ «НМИЦ Кардиологии» Минздрава России, академик РАН, профессор, д.м.н.
Карабашева Мадина Борисовна
— аспирант отдела гипертонии; e-mail (автор, ответственный за переписку)
Данилов Николай Михайлович
— д.м.н., ст. научный сотрудник отдела гипертонии
Матчин Юрий Георгиевич
— д.м.н., руководитель лаборатории рентгенэндоваскулярных методов диагностики и лечения в амбулаторных условиях
Возможные последствия легочной гипертензии
Риск развития осложнений повышается при развитии правожелудочковой сердечной недостаточности, но и на ранних стадиях гипертензии остается весьма существенным. К осложнениям относятся нарушения ритма сердца, острая сердечно – легочная недостаточность, массивная, остро развившаяся тромбоэмболия легочной артерии, в большинстве случаев заканчивающаяся молниеносной смертью. Каждое из них может закончиться летальным исходом.
Профилактикой развития осложнений является своевременное обращение к врачу, регулярное обследование и постоянный прием назначенных врачом препаратов.
Эпидемиология
По данным различных проспективных исследований, заболеваемость ХТЭЛГ варьирует от 0,4 до 14,7% среди выживших пациентов после перенесенной острой ТЭЛА. M. Zhang и соавт. (2018) в своем систематическом обзоре и метаанализе 15 когортных исследований приходят к выводу: ХТЭЛГ не является редким осложнением острой ТЭЛА, причем авторы отмечают особую важность проведения тщательного выявления и применения комплексного системного подхода в проводимом скрининге, особенно у пациентов группы риска [4]. В «классической» работе по оценке эпидемиологии ХТЭЛГ (V. Pengo и соавт., 2004) кумулятивная заболеваемость симптоматической ХТЭЛГ, вторичной по отношению к острой ТЭЛА, отмечалась в 1,0% в течение 6 мес, 3,1% к первому году и 3,8% случаев на втором году в проспективном долгосрочном исследовании. Авторы также приходят к выводу о том, что ХТЭЛГ является относительно распространенным и серьезным осложнением легочной эмболии, и также высказываются о необходимости проведения систематических мероприятий по раннему выявлению и профилактике ХТЭЛГ [5].
Прогноз
Прогноз при отсутствии лечения неблагоприятный, так как большинство пациентов погибает в первый год от появления выраженных клинических симптомов и постановки диагноза. При своевременной диагностике и применении лекарственных препаратов прогноз благоприятный, а пятилетняя выживаемость составляет порядка 95%.
У детей, перенесших легочную гипертензию в периоде новорожденности и получавших адекватное лечение, прогноз благоприятный – выживаемость детей составляет более 75%. Большинство маленьких пациентов в дальнейшем не отстают в развитии от сверстников. Неврологические осложнения могут развиться у детей, перенесших длительную искусственную вентиляцию легких.
Группа риска
Легочная гипертензия вследствие хронической тромбоэмболии возникает у людей, страдающих такими патологиями:
- воспаление кишечника;
- пороки сердца;
- недостаточность щитовидной железы;
- злокачественные новообразования;
- тромбофилия;
- ожирение;
- беременность и роды;
- варикозная болезнь;
- курение;
- малоактивный образ жизни;
- гормональный сбой;
- травматическое повреждение органов груди;
- состояние после удаления селезенки;
- тромбоз вен пищевода;
- перенесенный остеомиелит.
Патология чаще всего возникает в молодом возрасте, а также у лиц, что часто болеют инфекционными заболеваниями.