Дисплазия соединительной ткани – иное наименование по МКБ 10 состояния врождённой неполноценности соединительнотканной составляющей человеческого организма. При нарушении происходит отклонение в строении, росте на этапах созревания и дифференцировки соединительной ткани, во внутриутробном периоде и в первые месяцы после рождения у детей. Причины аномалий развития заключаются в генетических нарушениях, затрагивающих фиброгенез внеклеточных структур. Как следствие отклонения, происходит дисбаланс гомеостаза органов и систем, нарушение их структуры и функций с постоянным прогрессированием у детей и взрослых.
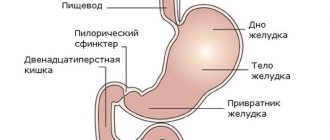
Элементы соединительнотканной структуры входят в состав органов и кожи человека. Ткань бывает рыхлая либо обнаруживает плотную структуру. Находится в составе кожи, костно-мышечной системе, сосудах, крови, полых органах и мезенхимальных структурах. Главную функцию в структуре соединительной ткани выполняет коллаген. Обеспечивает сохранение объёма и формы органа. Эластин несет ответственность за гибкость и релаксацию тканевых элементов кожи.
Патология соединительной ткани
Дисплазия соединительной ткани предопределяется генно-обусловленными трансформациями в форме мутаций генов, несущих ответственность за её выработку и созревание, определяется как наследственная патология. Мутации способны носить разнообразный характер, поражать любые гены. Впоследствии случаются отклонения в формировании коллагена, эластина. В результате органы и ткани не справляются с предлагаемой динамической и статической нагрузкой.
Виды дисплазии соединительнотканных элементов
- Дифференцированная соединительнотканная дисплазия. Тип характеризуется выраженностью клинических проявлений и хорошо исследованными мутациями чётко определённых участков генной цепочки. Альтернативное название группы по МКБ 10 – коллагенопатии. Включают ряд наследственных расстройств формирования и созревания коллагена.
- Недифференцированная форма у детей устанавливается, когда не удаётся установить аналогии ни с одним из известных генетических нарушений, нет ни одного признака дифференцированного расстройства.
Недифференцированная форма встречается чаще. Способна поражать людей в любом возрасте, даже детей.
Стоит ли обращаться к врачам официальной медицины по поводу дисплазии соединительной ткани
Состояние гипермобильности суставов описано впервые русским врачом А.Черногубовым более 100 лет тому назад и в последние 30 лет интенсивно изучается.
Вот так относится к дисплазиям «официальная» медицина в лице специалистов Русмедсервера:
Обращающийся за помощью пациент: «. у меня гипермобильность суставов (так, по крайней мере, это мне “обозвали” на консультации), и если при постройке “смирно” ноги еще и можно назвать относительно ровными (вернее относительно кривыми), то во время походки колени старательно заворачиваются внутрь и кости и внешние мышцы на них также старательно выпячивают наружу. »
Ответ консультантов форума:
«Избыточная подвижность суставов – это одно из внешних проявлений диспластического синдрома. Это не болезнь, это Ваша особенность с рождения – просто Ваша соединительная ткань чуть более эластична, чем хотелось бы ортопедам-травматологам.
Не меньше 80-85% женщин (если не все 95) и около 20-30% мужчин имеют такие же данные. А про балет, хореографию, профессиональный спорт – художественную гимнастику, фигурное катание и некоторые другие – говорить даже нечего, других туда не берут. Не диспластикам там делать просто нечего, они не смогут добиться хороших результатов.
Представители этих профессий Вам хорошо знакомы (перечислять их даже не будем пытаться), и поверьте, все эти люди при желании и наличии определенных комплексов могут (вполне резонно) предъявлять жалобы, схожие с Вашими. Так что можете не переживать по этому поводу, можете считать, что Вам повезло, и при желании смело можете поступать в какое-нибудь хореографическое училище».
Этот ответ иначе как неграмотным назвать невозможно. Причем в нем перепутаны истина и ложь. Действительно, все представительницы спорта под названием «художественная гимнастика» диспластичны, у них – избыточная подвижность суставов. Но разве они здоровы?
«Обычно дети с гипермобильностью, с выворотностью, повышенной растяжимостью связок идут . правильно, в балет. Или в гимнастику. Для начала неплохо бы убедиться, что у них нет анатомических дефектов, меньше было бы смертей среди молодых спортсменов». А это – точка зрения кафедры внутренних болезней и семейной медицины Омской Государственной Медицинской Академии.
Главные жалобы больных с дисплазией
Подобных больных людей, детей с соединительнотканной патологией легко распознавать на улице. Больные люди, страдающие дисплазией соединительной ткани, показывают два основных характерных типа внешности. Один представлен людьми высокого роста с опущенными плечами, торчащими назад оттопыренными лопатками, другой тип внешности представлен малорослыми людьми субтильного сложения.
Жалобы пациентов носят разнообразный характер, несут мало информации для верификации диагноза.
- Общая слабость, недомогание и утомляемость, мышечная вялость.
- Боль в голове и животе.
- Расстройства пищеварения – вздутие кишечника и запоры, плохой аппетит.
- Снижение артериального давления.
- Нарушения в работе органов дыхания.
Достоверными считают симптомы, определяемые при объективной оценке состояние пациента:
- Астеническое сложение с дефицитом веса тела, астенический синдром.
- Расстройства строения и функций позвоночника, выражающиеся в сколиозах, деформациях грудной клетки, гипер- и гипо- лордозах или кифозах.
- Удлинение конечностей, пропорциональные изменения строения тела.
- Повышенная мобильность суставов, позволяющая проводить сгибания и разгибания больше нормы.
- Вальгусная деформация ног, симптомы плоскостопия.
- Изменения глаз – миопия, нарушения строения сетчатки.
- Со стороны сосудов встречается варикозная болезнь, повышенная проницаемость стенок сосудов для элементов крови.
Изменения претерпевает состояние кожи и хрящевые элементы. Кожа истончается и выглядит вялой, подвержена чрезмерной растяжимости. Сквозь неё просвечивают сосуды крови. Кожу можно безболезненно стянуть в пучок на лобной области, тыльной поверхности кистей, подключичных районах. На ушных раковинах или носу легко сформировать складку, чего не бывает у здорового человека.
Симптомы дисплазии
Зубы. Кости и суставы. Проблемы и профилактика у детей!
Зубы – это то, что может доставлять большие проблемы уже с детства. Чаще всего зубы у детей такие же или хуже, чем у их родителей. Тем не менее, у зубов есть один большой плюс, при определенных условиях, они могут полностью себя восстанавливать. Об этих свойствах зубов, о том, как они связаны с проблемами кишечника и о других проблемах костно-суставной ткани смотрите в видео:
Сегодня хочется сказать не о том, чтобы вы занимались профилактикой, а о том, что вы должны поддерживать свое здоровье. Если посмотреть на список заболеваний, то практически у каждого ребенка и взрослого человека можно найти 1, 2 или 3 проблемы, которые в будущем могут привести к серьезным заболеваниям. Именно поэтому они требуют внимания и помощи себе любимому.
Клапанный синдром
Синдром носит изолированный характер, характеризуется наличием пролапсов сердечных клапанов и их миксоматозного перерождения.
Чаще удаётся обнаружить симптомы пролапса митрального клапана, прочие клапаны подвержены поражению несколько реже, что подтверждает дополнительная диагностика. Возможны отклонения в развитии: дилатационные изменения корней грудной аорты и лёгочной артерии, синусовые аневризматические расширения. Нарушения строения сопровождаются явлениями обратного заброса крови, что оставляет отпечаток на общих гемодинамических показателях больного. Высказывается предположение, что в основе причин, вызывающих описанный синдром у детей, лежит недостаточность ионов магния, что подтверждает биохимическая диагностика.
Формирование расстройства в виде клапанного синдрома начинается у детей 5 лет. Первые аускультативные признаки определяются несколько позже. Данные электрокардиографии не всегда бывают показательными, зависят от возраста и прогрессирования заболевания, поэтому чаще их возможно обнаружить при повторных обращениях к врачу.
Недифференцированная дисплазия соединительной ткани с позиции дизэлементоза у детей и подростков
Дисплазией соединительной ткани (ДСТ) называют генетически детерминированное нарушение ее развития, характеризующееся дефектами ее основного вещества и волокон. В настоящее время среди основных причин ДСТ выделяют изменения темпов синтеза и сборки коллагена и эластина, синтез незрелого коллагена, нарушение структуры коллагеновых и эластиновых волокон вследствие их недостаточной поперечной сшивки [4]. Это свидетельствует о том, что при ДСТ дефекты соединительной ткани в своих проявлениях весьма разнообразны. В основе указанных морфологических нарушений лежат наследственные либо врожденные мутации генов, непосредственно кодирующих соединительнотканные структуры, ферменты и их кофакторы, а также неблагоприятные факторы внешней среды. В последние годы особое внимание привлечено к патогенетической значимости дизэлементоза, в частности гипомагниемии. Иными словами, ДСТ представляет собой многоуровневый процесс, т.к. она может проявляться на генном уровне, на уровне дисбаланса ферментативного и белкового обмена, а также на уровне нарушения гомеостаза отдельных макро– и микроэлементов [4]. Выделяют две группы ДСТ. К первой группе относят редко встречающиеся дифференцированные дисплазии с известным генным дефектом определенного типа наследования и с четкой клинической картиной (синдромы Марфана, Элерса–Данлоса, несовершенный остеогенез и др.). Эти заболевания относятся к наследственным болезням коллагена – коллагенопатиям [1,5]. Вторую группу составляют недифференцированные ДСТ (НДСТ), наиболее часто встречающиеся в педиатрической практике. В отличие от дифференцированных дисплазий НДСТ – это генетически гетерогенная патология, обусловленная изменениями в геноме вследствие мультифакторных воздействий на плод внутриутробно. В подавляющем большинстве случаев генный дефект при НДСТ остается неустановленным. Основной характеристикой этих дисплазий является широкий спектр клинических проявлений без определенной четкой клинической картины. НДСТ – это не нозологическая единица, и места ей в МКБ–10 пока не нашлось. Разработана классификация внешних и внутренних признаков (фенов) НДСТ [6]. Внешние признаки подразделяются на костно–скелетные, кожные, суставные и малые аномалии развития. К внутренним признакам относятся диспластические изменения со стороны нервной системы, зрительного анализатора, сердечно–сосудистой системы, органов дыхания, брюшной полости (рис. 1). Отмечено, что синдром вегетативной дистонии (ВД) формируется одним из первых и является обязательным компонентом ДСТ [1]. Симптомы вегетативной дисфункции наблюдаются уже в раннем возрасте, а в подростковом периоде отмечаются в 78% случаев НДСТ. Выраженность вегетативной дизрегуляции нарастает параллельно с клиническими проявлениями дисплазии [7]. В формировании вегетативных сдвигов при ДСТ имеют значение как генетические факторы, лежащие в основе нарушения биохимических процессов в соединительной ткани, так и формирование аномальных соединительнотканных структур, что в совокупности изменяет функциональное состояние гипоталамуса и приводит к вегетативному дисбалансу. К особенностям ДСТ относится отсутствие или слабая выраженность фенотипических признаков дисплазии при рождении, даже в случаях дифференцированных форм. У детей с генетически детерминированным состоянием маркеры дисплазии проявляются постепенно в течение жизни [8]. С годами, особенно при неблагоприятных условиях (экологическая обстановка, питание, частые интеркуррентные заболевания, стрессы), количество диспластических признаков и степень их выраженности прогредиентно нарастают, т.к. исходные изменения гомеостаза усугубляются указанными факторами внешней среды. В первую очередь это касается гомеостаза отдельных макро– и микроэлементов, принимающих непосредственное участие в синтезе коллагена, коллагеновых и эластиновых волокон, а также в модуляции активности ферментов, определяющих скорость синтеза и качество соединительнотканных структур. Это касается прежде всего таких макроэлементов, как магний и кальций и эссенциальных микроэлементов – меди, цинка, марганца, и условно эссенциального – бора. Среди многообразия метаболических функций указанных элементов в организме следует выделить их непосредственное участие в процессах коллагенообразования, а также в формировании, нормальном развитии скелета и поддержании его структуры [9–11]. В настоящее время доказано влияние дефицита магния на структуру соединительной и костной ткани, в частности, на коллаген, эластин, протеогликаны, коллагеновые волокна, а также на минерализацию костного матрикса. Имеющиеся литературные данные свидетельствуют о том, что воздействие дефицита магния на соединительную ткань приводит к замедлению синтеза всех структурных компонентов, усилению их деградации, что значимо ухудшает механические характеристики ткани [12]. Дефицит магния не имеет патогномоничных клинических признаков. Однако полисимптомность этого состояния позволяет на основании клинической картины с большой долей вероятности заподозрить его дефицит у пациента. Дефицит магния в течение нескольких недель может приводить к патологии сердечно–сосудистой системы, выражающейся ангиоспазмом, артериальной гипертензией, дистрофией миокарда, тахикардией, аритмией, увеличением интервала QT, склонностью к тромбозам; к психоневрологическим нарушениям, проявляющимся в виде снижения внимания, депрессии, страхов, тревожности, вегетативной дисфункции, головокружений, мигрени, нарушений сна, парестезий, мышечных судорог; висцеральные проявления дефицита включают бронхоспазм, ларингоспазм, гиперкинетические диареи, спастические запоры, пилороспазм, тошноту, рвоту, дискинезии желчевыводящих путей, диффузные абдоминальные боли. Хронический дефицит магния в течение нескольких месяцев и более наряду с вышеуказанной симптоматикой сопровождается выраженным снижением мышечного тонуса, резкой астенизацией, соединительнотканной дисплазией и остеопенией. Благодаря множеству клинических эффектов магний широко используется в качестве лекарственного средства при различных заболеваниях. Общеизвестна роль кальция и магния как основных элементов, участвующих в формировании одного из видов соединительной ткани – костной ткани. Доказано, что магний значительно улучшает качество костной ткани, т.к. его содержание в скелете составляет 59% от общего содержания в организме (рис. 2). Известно, что магний непосредственно влияет на минерализацию органического костного матрикса, коллагенообразование, функциональное состояние костных клеток, обмен витамина Д, а также на рост кристаллов гидроксиапатита [13]. В целом прочность и качество структур соединительной ткани во многом зависят от наличия баланса между кальцием и магнием. При дефиците магния и нормальном либо повышенном уровне кальция возрастает активность протеолитических ферментов – металлопротеиназ – ферментов, вызывающих ремоделирование (деградацию) коллагеновых волокон, вне зависимости от причин, вызвавших аномалии в структуре соединительной ткани, что приводит к избыточной деградации соединительной ткани, следствием которой являются тяжелые клинические проявления НДСТ [4]. Гомеостаз магния и кальция в организме зависит от адсорбции элементов в кишечнике, процесса реабсорбции в почечных канальцах, гормональной регуляции и от пищевого рациона, т.к. последний является единственным источником их поступления в организм. Магний оказывает регулирующее влияние на использование организмом кальция. Недостаточное поступление магния в организм приводит к отложению кальция не только в костях, но и в мягких тканях и различных органах. Избыточное потребление пищи, богатой магнием, нарушает усвоение кальция и вызывает усиленное его выведение [14]. Соотношение магния и кальция – основная пропорция организма, и это необходимо учитывать в рекомендациях пациенту по рациональному питанию. Количество магния в пищевом рационе должно составлять 1/3 от содержания кальция (в среднем на 1000 мг кальция 350–400 мг магния). Проведенные в последние десятилетия фундаментальные исследования микроэлементов выявили их значимость в биохимических процессах, лежащих в основе формирования соединительной ткани. Доказано, что многие микроэлементы являются неотъемлемыми компонентами ферментных систем, от активности которых зависят метаболизм соединительной ткани, процессы синтеза и ремоделирования ее структурных компонентов [9,15,16]. Медь определяет активность фермента лизилоксидазы, участвующего в образовании поперечных сшивок цепей коллагена и/или эластина, что придает соединительнотканному матриксу зрелость, упругость и эластичные свойства. Цинк необходим для функционирования многих металлоферментов, регулирующих ремоделирование коллагена в соединительной и костной тканях. Марганец активизирует целый ряд ферментов, непосредственно участвующих в синтезе основных белков соединительной ткани – протеогликанов и коллагена, т.е. тех белков, которые определяют рост и структуру костной, хрящевой, соединительной тканей в организме [17]. Роль бора значима в процессах остеогенеза, что обусловлено его влиянием на метаболизм витамина Д, а также регуляцией активности паратиреоидного гормона, который, как известно, ответственен за обмен кальция, фосфора и магния [13]. В клиническом аспекте литературные данные, касающиеся исследования микроэлементов у детей и подростков, в основном посвящены изучению микроэлементозов при воздействии различных факторов окружающей среды, а также при дисгармоничном физическом развитии, патологии мочевой системы, хронических заболеваниях гастродуоденальной зоны, атопическом дерматите, соматовегетативных и психоневрологических расстройствах, органической патологии центральной нервной системы [18–21]. Исследования, проведенные американскими учеными, показали, что дефицит таких элементов, как медь, бор, марганец, цинк и магний ведет к росту числа костных деформаций. При этом отмечено, что за последние 10 лет частота вышеуказанной патологии увеличилась на 46,96% [22]. При литературном поиске сведений об исследовании комплекса микроэлементов, принимающих непосредственное участие в формировании структурных компонентов соединительной ткани и остеогенезе (бора, меди, марганца, цинка), при ДСТ нам встретить не удалось. Имеется лишь единичное исследование баланса отдельных микроэлементов (бора, цинка) при диспластикозависимой патологии соединительной ткани у детей [11]. Методом случайной выборки обследовано 60 детей и подростков в возрасте 9–17 лет, госпитализированных в соматическое отделение Тушинской детской городской больницы г. Москвы по поводу ВД. Обследуемые дети и подростки были разделены на две группы в зависимости от наличия НДСТ. Основную группу составили 30 пациентов с НДСТ (1 группа), группу сравнения – 30 человек, у которых признаки ДСТ отсутствовали (2 группа). Внешние и соматические признаки НДСТ у обследуемых пациентов 1–й группы приведены в таблице 1. Проведенные нами исследования комплекса микроэлементов в волосах (бора, меди, марганца, цинка), содержания кальция в моче, минеральной плотности костной ткани (МПКТ) выявили выраженные изменения в элементном гомеостазе у пациентов с НДСТ. Среднее содержание микроэлементов у пациентов 1 и 2–й групп приведено в таблице 2. Анализ полученных данных показал, что у пациентов 1–й группы имел место дисбаланс в микроэлементном статусе, который характеризовался достоверными изменениями исследуемых микроэлементов (p<0,05). При этом отмечено значимое снижение содержания бора и марганца, сочетающееся с повышением уровня меди и цинка. Во 2–й группе определялась лишь тенденция к повышению меди и цинка в сочетании со снижением уровня марганца, содержание бора оставалось в норме. Выраженный дефицит бора и марганца в 1–й группе и достоверное снижение марганца во 2–й группе можно объяснить не только низким потреблением микроэлементов с продуктами питания, но и их зависимостью от уровня кальция и магния в организме. Известно, что у детей и подростков в период активного роста и формирования пиковой костной массы темпы потребления указанных макроэлементов в организме возрастают. Это может явиться одной из причин патологического снижения усвоения других биологически активных веществ, в частности отдельных микроэлементов (бора, марганца) и, соответственно, их дефицита в организме. Кроме того, существует точка зрения о том, что при дефиците магния марганец способен его замещать в активных центрах отдельных ферментов, участвующих в синтезе коллагена и остеогенезе, и выполнять те же функции [4]. Из сказанного следует, что дефицит магния приводит к снижению содержания марганца в организме. Наблюдаемое достоверное повышение содержания цинка и меди в волосах у пациентов 1–й группы, вероятно, обусловлено снижением уровня кальция в организме. Имеются данные, что при дефиците кальция происходит ускорение темпов накопления цинка в волосах у детей с НДСТ [11]. Очевидно, что пороговые значения потребления кальция приводят к торможению обмена цинка и меди, т.к. их участие в синтезе коллагена, формировании костной ткани и в других жизненно важных функциях возможно лишь при адекватном поступлении кальция в организм. При определении суточного потребления кальция выявлено недостаточное его содержание в пищевом рационе у пациентов 1 и 2–й группы. Среднесуточное потребление кальция в 1–й группе составляло 425±35 мг, во 2–й группе – 440±60 мг, при нормативах суточной потребности в возрасте 10–18 лет 1200 мг [19]. Отмечено отчетливое снижение экскреции кальция в утренней порции мочи у пациентов 1–й группы (1,2+0,02 ммоль/л при норме 2,5–6,2), что является отражением выраженного дефицита минерала в организме и позволяет полагать, что потребность в кальции при НДСТ гораздо выше, чем при ее отсутствии. Дефицит кальция подтвердили и результаты денситометрического исследования, которые выявили снижение костной минерализации у 18 пациентов 1–й группы и у 8 человек из 2–й группы (рис. 3). Анализ результатов показал, что степень деминерализации костной ткани соответствовала остеопении, однако у 17% подростков 1–й группы диагностирован остеопороз. Эти подростки не имели соматических заболеваний, способных вызвать патологическое снижение костной массы, поэтому выявленный остеопороз не рассматривался как транзиторный. Проявлением НДСТ у них являлось максимальное количество внешних фенотипических признаков в сочетании с 2–3 соматическими признаками, обращала внимание выраженность сдвигов в содержании всех четырех исследуемых микроэлементов. Таким образом, проведенные исследования кальциевого гомеостаза являются аргументом, подтверждающим влияние дефицита кальция на формирование микроэлементоза, и диктуют необходимость дотации кальция в балансе с магнием пациентам с НДСТ. Литературные данные и результаты собственных исследований свидетельствуют о значимости дизэлементоза в развитии НДСТ, и это, вероятно, позволяет рассматривать ДСТ как один из клинических вариантов дизэлементоза. Из сказанного следует, что для устранения соединительнотканных дефектов и предотвращения прогрессирования дисплазии необходима коррекция дизэлементоза. Восстановление нарушенного элементного гомеостаза достигается рациональным питанием, дозированной физической нагрузкой, улучшающей усвояемость макро– и микроэлементов, а также применением препаратов магния, кальция, микроэлементов и витаминов. Пищевые источники магния, кальция и микроэлементов (марганца, меди, цинка, бора) приведены в таблице 3. В настоящее время патогенетически обоснована терапия НДСТ магнийсодержащими лекарственными препаратами. Восполнение дефицита магния в организме приводит к снижению активности вышеуказанных ферментов–металлопротеиназ и, соответственно, к уменьшению деградации и ускорению синтеза новых молекул коллагена. Результаты магниевой терапии у детей с НДСТ (главным образом с пролапсом митрального клапана, с аритмическим синдромом на фоне вегетативной дисфункции) показали их высокую эффективность [7,24–26]. В педиатрической практике находят широкое применение различные магнийсодержащие препараты, различающиеся по своей химической структуре, уровню содержания магния и способам введения. Возможности назначения неорганических солей магния для длительной пероральной терапии ограничены из–за крайне низкой всасываемости в желудочно–кишечном тракте и способности вызывать диарею. В связи с этим предпочтение отдается органической соли магния (соединению магния с оротовой кислотой), хорошо адсорбирующейся в кишечнике, и только при применении высоких доз возможен побочный эффект в виде неустойчивого стула. Магниевая соль оротовой кислоты выпускается в таблетках по 500 мг (32,8 мг элементарного магния) под названием Магнерот (Woеrwag Pharma, Германия). Применение оротовой соли магния оправданно в связи с тем, что оротовая кислота способна фиксировать внутриклеточный магний в митохондриях, где только при наличии магниевых ионов возможен синтез АТФ, определяющий функциональное состояние и жизнеспособность каждой клетки в организме, в том числе и соединительнотканной. Более того, оротовая кислота, участвуя в синтезе нуклеиновых кислот, оказывает анаболическое действие путем стимуляции синтеза протеинов, включая основные белки соединительной ткани, в чем она синергична с магнием [27]. Рекомендуемые дозы препарата Магнерот в зависимости от возраста представлены в таблице 4. Нами проведена оценка эффективности магниевой терапии у 24 детей и подростков, у которых одним из фенов НДСТ была вегетативная дистония, протекавшая с кардиальными изменениями. Продолжительность курса лечения составляла 3 нед. Характер жалоб в основном носил неспецифический характер, при этом наиболее часто отмечались утомляемость, раздражительность, тревожность, эмоциональная лабильность, головная боль, трудности засыпания. У подростков с ВД по симпатикотоническому и смешанному типу имела место артериальная гипертензия I–й степени (у 9 чел.) и лабильная АГ (у 5 чел.). Кардиальные жалобы были незначительными и выражались кратковременными кардиалгиями у 25% пациентов, сердцебиением – у 12,5%, ощущением усиленных сокращений сердца, появлявшихся в момент физической нагрузки и при волнении, реже в покое, – у 8% больных. Однако при анализе ЭКГ изменения были выявлены практически у всех обследуемых. В процессе обследования исключены органическая патология сердца и симптоматическая АГ. В период проведения терапии пациенты не получали препаратов, улучшающих трофику миокарда, антиаритмических, гипотензивных и вегетотропных средств. После окончания курса магниевой терапии полностью исчезли кардиальные жалобы, нормализовался сон, уменьшились проявления эмоциональных и поведенческих расстройств. Применение магниевой терапии сопровождалось гипотензивным эффектом у всех пациентов с АГ. Полная нормализация АД имела место в 62% случаев. У 5 пациентов с АГ 1–й степени отмечена лишь тенденция к снижению АД. При оценке ЭКГ выявлена отчетливая положительная динамика, выразившаяся в нормализации зубца Т (66%), полном исчезновении волны U, уменьшении инверсии зубца Т (14%), смене инверсии зубца Т на его уплощение (9,5%), положительной динамике синусовой тахикардии с нормализацией ЧСС (62,5%), исчезновении экстрасистолии, нормализации интервала QT, отсутствии неспецифической депрессии сегмента ST. Однако у 11,5% больных синусовая тахикардия оказалась торпидной к проводимой терапии. Не отмечено существенной динамики ЭКГ при брадиаритмии на фоне миграции водителя ритма у 8% пациентов (табл. 5). Оценивая эффективность магниевой терапии для коррекции нейровегетативной дизрегуляции у пациентов с НДСТ, можно сделать вывод, что положительная динамика психоэмоциональных расстройств, ЭКГ–изменений, вплоть до полной нормализации отдельных показателей, наступает при 3–недельной продолжительности курсового лечения. Однако при синусовой тахикардии, нарушении процессов реполяризации с инверсией зубца Т, стабильной артериальной гипертензии требуются более длительные сроки лечения. При необходимости назначения кардиотрофических, гипотензивных и вегетотропных средств следует рекомендовать препараты магния в качестве компонента комбинированной терапии. Таким образом, редукция одного из клинических проявлений НДСТ – вегетативной дисфункции, на фоне магниевой терапии является одним из фактов, подтверждающих значимость дизэлементоза в развитии ДСТ. Результаты исследования элементного гомеостаза свидетельствуют о необходимости его коррекции с помощью препаратов магния, кальция, микроэлементов в качестве патогенетической терапии, способной предотвратить прогрессирование НДСТ у детей и подростков.
Литература 1. Земцовский Э.В. Соединительнотканные дисплазии сердца. – СПб: ТОО «Политекс–Норд–Вест», 2000. – 115 с. 2. Шиляев Р.Р., Шальнова С.Н. Дисплазия соединительной ткани и ее связь с патологией внутренних органов у детей и взрослых // Вопр. соврем. педиатрии. – 2003. – № 5 (2). – С. 61–67. 3. Cole W.G. Collagen genes: mutations affecting collagen structure and expression // Prog. Nucleic. Acid. Res. Mol. Biol. 1994. Vol. 47. P. 29–80. 4. Громова О.А. Молекулярные механизмы воздействия магния на дисплазию соединительной ткани // Дисплазия соединит. ткани. – 2008. – № 1. – С. 23–32. 5. Кадурина Т.И. Наследственные коллагенопатии (клиника, диагностика, лечение и диспансеризация). – СПб.: Невский диалект, 2000. – 271 с. 6. Земцовский Э.В. Недифференцированные дисплазии соединительной ткани. Состояние и перспективы развития представлений о наследственных расстройствах соединительной ткани // Дисплазия соединит. ткани. – 2008. – № 1. – С. 5–9. 7. Нечаева Г.И., Друк И.В., Тихонова О.В. Терапия препаратами магния при первичном пролапсе митрального клапана // Лечащий врач. – 2007. – № 6. – С. 2–7. 8. Нечаева Г.И. Вариабельность сердечного ритма у пациентов молодого возраста с дисплазией соединительной ткани // Дисплазия соединит. ткани. – 2008. – № 1. – С. 10–13. 9. Скальная М.Г., Нотова С.В. Макро– и микроэлементы в питании современного человека; эколого–физиологические и социальные аспекты. – М.: РОМЭМ, 2004. – 310 с. 10. Баранов А.А., Кучма В.Р., Рапопорт И.К. Руководство по врачебному профессиональному консультированию подростков. – М.: Издательский дом «Династия», 2004. – 200 с. 11. Фролова Т.В., Охапкина О.В. Особенности микроэлементного баланса при диспластикозависимой патологии недифференцированной дисплазии соединительной ткани у детей // Рос. сб. науч. трудов с междунар. участием «Педиатрические аспекты дисплазии соединительной ткани. Достижения и перспективы». – Москва–Тверь–Санкт–Петербург, 2010. – С. 86–91. 12. Торшин И.Ю., Громова О.А. Дисплазия соединительной ткани, клеточная биология и молекулярные механизмы воздействия магния // Ремедиум. – 2000. – С. 31–33. 13. Спиричев В.Б. Роль витаминов и минеральных веществ в остеогенезе и профилактике остеопении у детей // Вопр. дет. диетологии. – 2003. – Т. 1(1). – С. 40–49. 14. Котова С.М., Карлова Н.А., Максимцева И.М., Жорина О.М. Формирование скелета у детей и подростков в норме и патологии: пособие для врачей. – СПб, 2002. – 44 с. 15. Тутельян В.А., Спиричев В.Б., Суханов Б.П., Кудашева В.А. Микронутриенты в питании здорового и больного человека: справочное руководство по витаминам и минеральным веществам. – М.: Колос, 2002. – С. 174–175. 16. Persicov А.V., Brodsky B. Unstable molecules form stable tissues // Proc. Natl. Acad. Sci. 2002. Vol. 99(3). P. 1101–1103. 17. Оберлис Д., Харланд Б., Скальный А., Биологическая роль макро–и микроэлементов у человека и животных. – СПб: Наука, 2008. – C. 145–418. 18. Кузнецова Е.Г., Шиляев Р.Р. Биологическая роль эссенциальных макро– b микроэлементов и нарушения их гомеостаза при пиелонефрите у детей // Педиатр. фармакология. – 2007. – Т. 4(2). – С. 53–57. 19. Дубовая А.В., Коваль А.П., Гончаренко И.П. Результаты исследования элементного гомеостаза детей с атопическим дерматитом: Материалы 71–й Международной научно–практической конференции молодых ученых «Актуальные проблемы клинической, экспериментальной, профилактической медицины, стоматологии и фармации». – Донецк, 2008. – С. 30–31. 20. Лучанинова В.Н., Транковская Л.В., Зайко А.А. Характеристика и взаимосвязь элементного статуса и некоторых иммунологических показателей у детей с острыми респираторными заболеваниями // Педиатрия. – 2004. – № 4. – С. 22–26. 21. Кадурина Т.И., Аббакумова Л.Н. Принципы реабилитации больных с дисплазией соединительной ткани // Лечащий врач. – 2010. – Т. 40. – С.10–16. 22 Бергнер П. Целительная сила минералов, особых питательных веществ и микроэлементов. – М.: Крон–Пресс, 1998. – 288 с. 23. Нормы физиологических потребностей в пищевых веществах и энергии для различных групп населения СССР. МЗ СССР : Метод. рекомендации – М., 1991. 24. Школьникова М.А. Метаболизм магния и терапевтическое значение его препаратов. – М.: Медпрактика, 2002. – 28с. 25. Пшепий А.Р. Оценка эффективности терапии преператом Магнерот при различных диспластических синдромах и фенотипах // Дисплазия соединит. ткани. – 2008. – № 1. – С.19–22. 26. Басаргина Е.Н. Синдром дисплазии соединительной ткани сердца у детей // Вопр. соврем. Педиатрии. – 2008. – Т. 1 (7). – С. 1–4. 27. Применение магния и оротовой кислоты: методическое пособие. – М: Медпрактика–М, 2002. – 20 с. 28. Altura B.M. Basic biochemistry and physiology of magnesiym; A brief reviem // Magnesium and Frace Elements. 1991. Vol. 10. P. 167–171.
Торакодиафрагмальные изменения
Признаки, которыми характеризуется синдром, легко определяются при визуальном осмотре:
- Грудная клетка имеет астеническую форму, бывает килевидной или приобретает форму воронки.
- Позвоночник проявляет всевозможные виды деформации.
- Уровень стояния и объем движений диафрагмы изменён, если сравнивать с нормальным.
В большинстве случаев у больного с соединительнотканной патологией возможно встретить грудную клетку, имеющую воронкообразный вид, немного реже килевидную.
Начало формирования и прогрессирования торакодиафрагмального синдрома приходится на детский возраст, к началу пубертатного возраста уже имеет сформировавшиеся клинические признаки.
Визуальные признаки
Данная патология влечёт признаки нарушения дыхательных функций, ограничение жизненной емкости лёгких, нарушение нормальной структуры и функций бронхиального дерева и трахеи, нарушение положения сердца в средостении, деформацию крупных сосудов. Изменения, носящие количественный либо качественный характер, влияют на степень интенсивности всех объективных проявлений и функционирования органов дыхания и сердца.
Нарушение строения формы рёберной дуги грудины приводят к ограничению объёма грудной клетки, повышению воздушного давления в ней, нарушают нормальный ток крови по сосудам, становятся причиной расстройств сердечного ритма.
Соединительная ткань и здоровье человека
Тело человека примерно на 20% состоит из клеток, а остальные 80% занимает соединительная ткань – межклеточный матрикс, окружающий клетки. Все лечебно-оздоровительные процедуры (массаж, самомассаж, акупунктура и пр.) проводят путем воздействия на соединительную ткань. Поэтому сегодня мы поговорим о её роли в организме человека..
Тело человека примерно на 20% состоит из клеток, а остальные 80% занимает соединительная ткань – межклеточный матрикс, окружающий клетки. Все лечебно-оздоровительные процедуры (массаж, самомассаж, акупунктура и пр.) проводят путем воздействия на соединительную ткань. Поэтому сегодня мы поговорим о её роли в организме человека.
Соединительная ткань является самой разноплановой , к ней относятся: кровь и лимфа, жировая ткань, костная, хрящевая и собственно соединительная ткань. Она обладает очень важной функцией, так как соединяет все клетки воедино, создавая возможность общения каждой клетки с миллиардами других клеток; определяет форму и строение органов и тканей, форму и строение тела и имеет четкое представление, как должен функционировать здоровый организм.
Сосудистые патологические состояния
Сосудистый синдром заключается в поражении артериального русла. Стенки артерий разного калибра расширяются и формируются аневризмы, развивается повышенная извитость сосудов, варикозные поражения венозной сети нижних конечностей, малого таза, развиваются телеангиоэктазии.
Сосудистые расстройства влекут увеличение тонуса в просвете сосудов, уменьшение скорости и объема заполнения сосудов кровью, уменьшение тонуса в периферической венозной сети, характеризуются застойными явлениями в периферических сосудах конечностей.
Манифестация состояния, когда развивается сосудистый синдром, происходит в подростковом либо юношеском возрасте, постепенно нарастая.
Клиническое наблюдение 1
Пациентка Ш., 32 лет. Беременность повторная, в анамнезе срочные самопроизвольные роды без осложнений. Направлена в поликлинику МОНИИАГ с подозрением на частичный пузырный занос. При УЗИ в 15 нед выявлено утолщение плаценты до 32 мм, примерно 1/3 площади плаценты с измененной структурой — множественными мелкими гипо- и анэхогенными включениями размером до 3 мм (рис. 1). Маркеров хромосомных аномалий и пороков развития плода не выявлено. Уровень ХГЧ в пределах нормы. Заключение УЗИ: беременность 15 нед, частичный пузырный занос. Учитывая отсутствие аномалий развития плода, принято решение о пролонгировании беременности. Течение беременности осложнилось задержкой внутриутробного роста плода. Проводилась стандартная терапия вазоактивными препаратами. Родоразрешена при беременности 37 нед, произошли самопроизвольные роды, родилась девочка с массой тела 2800 г, ростом 46 см, что соответствует гипотрофии плода I степени, с оценкой по шкале Апгар 8-9 баллов. Кровопотеря в родах 350 мл. Послеродовый период протекал без осложнений.
Рис. 1.
Пациентка Ш. Структурные изменения плаценты.
а)
15 недель беременности.
б)
37 недель беременности.
Диагностика МДП проведена при гистологическом исследовании плаценты.
Нарушения дыхательной системы
Основными признаками становятся нарушения нормальных движений ворсинок эпителия бронхиального дерева и трахеи, расширение и истончение просвета бронхов, нарушения вентиляционных способностей лёгких. В тяжёлых случаях развивается спонтанный пневмоторакс.
Спонтанный пневмоторакс
Развитие осложнения, называемого бронхолёгочный синдром, связано с нарушением формирования перегородок между альвеолами, недостаточного развития эластиновых элементов и гладкой мышечной структуры. Это приводит к усиленной растяжимости небольших альвеол и бронхиол, снижению эластичности всех структурных элементов лёгочной ткани. Частные случаи поражения отдельных компонентов дыхательной системы, поражающие детей сегодня, расцениваются клиницистами в виде врождённых пороков развития.
Интенсивность развития изменений функциональных способностей зависит от величины выраженности морфологических изменений. Как правило, снижается жизненная ёмкость лёгких, хотя остаточный объем в лёгких не обязательно должен изменяться. У ряда больных наблюдаются явления обструкции бронхов, небольших бронхиол. Отмечается феномен повышенной реактивности бронхиального дерева, не нашедший до сих пор вразумительного объяснения.
Люди, у которых дисплазия соединительной ткани поражает органы дыхания, часто подвержены сопутствующей патологии типа туберкулёза лёгких.
О дисплазии и ее причинах
Соединительная ткань (СТ) присутствует во всех органах человеческого тела, но большее ее количество сосредоточено в опорно-двигательном аппарате. Она обеспечивает нормальную подвижность суставов. В ее состав входят:
- разные виды белка – коллаген, эластин, фибриллин и др.;
- клетки;
- межклеточная жидкость.
Соединительная ткань имеет различную структуру и плотность, это зависит от того, в каком органе она находится. Плотность придает коллаген, а эластин делает ткани рыхлыми. За процесс синтеза белка отвечают гены. Когда происходит нарушение на генном уровне, мутация, коллагеновые и эластиновые цепочки формируются неправильно – их длина уменьшается или увеличивается. Это приводит к ухудшению свойств соединительной ткани. В итоге она теряет часть своих свойств и уже не может обеспечивать нормальную работу суставов.
Иммунологические расстройства
Проявляются по принципу снижения иммунного ответа и ряда аутоиммунных расстройств и аллергических реакций различной степени развития.
При дисплазии соединительной ткани у человека развивается активация либо уменьшение активности механизмов иммунного ответа, несущих в организме ответственность за поддержание гомеостаза. Нарушается способность нормально реагировать на проникновение чужеродных агентов. Подобное приводит к частому развитию инфекционных осложнений различного генеза, особенно широко поражается система органов дыхания. Иммунологические отклонения выражаются в количественных изменениях содержания плазме крови количества иммуноглобулинов.
Прочие синдромы, характерные дисплазии соединительной ткани
- Висцеральный синдром выражается в эктопии и дистопии внутренних органов, дискинезиях, грыжах.
- Зрительные расстройства являют собой миопию, астигматические нарушения, косоглазие, нарушения нормальной деятельности сетчатки до полной отслойки, косоглазие и подвывихи хрусталика.
- Мезенхимальная дисплазия затрагивает систему крови и выражается в гемоглобинопатиях, расстройствах: геморрагический синдром, тромбоцитопатия.
- Патология стоп заключается в развитии косолапости или плоскостопия. Развитие патологии стопы и нижних конечностей приводит к стойким двигательным расстройствам и социальной дезадаптации.
- Гипермобильность суставов часто обнаруживается у детей уже в раннем возрасте. После 20 лет частота встречаемости патологии снижается.
Классификация
Все проявления данной патологии можно разделить на 2 большие группы:
- Дифференцированная дисплазия. Генные дефекты дифференцированной дисплазии хорошо изучены, а клинические симптомы ярко выражены. К этой группе относятся синдром Марфана, синдром Элерса-Данлоса, несовершенный остеогенез.
- Недифференцированная дисплазия. Этот диагноз ставят, если признаки патологии не укладываются в рамки дифференцированных синдромов.
Синдром Марфана
Является самым частым из дифференцированных дисплазий. Причиной патологии является дефект гена FBN1, отвечающего за синтез фибриллина. В результате волокна соединительной ткани теряют свою упругость и прочность. По степени выраженности синдром Марфана может сильно варьировать. От легкой (внешне практически неотличимой от обычных людей) до тяжелой, приводящей к смерти от сердечной недостаточности на первом году жизни.
Для таких людей характерно:
- Высокий рост.
- Длинные конечности.
- Длинные, тонкие, гиперподвижные пальцы рук.
- Нарушения зрения (подвывих хрусталика, голубые склеры, близорукость, отслойка сетчатки).
- Сердечно-сосудистые нарушения. Чаще всего бывает пролапс митрального клапана, врожденные пороки сердца, нарушения ритма, аневризма аорты.
Арахнодактилия (паучьи пальцы) при синдроме Марфана
Такие пациенты находятся под контролем нескольких специалистов – кардиолога, офтальмолога, терапевта, ортопеда. У них велик риск внезапной смерти. Продолжительность жизни зависит от степени выраженности нарушений, в первую очередь, в сердечно-сосудистой системе. Так, 90% больных не доживают до возраста 45 лет.
Синдром Элерса-Данлоса (синдром гиперэластичной кожи)
Это группа наследственных заболеваний (выделяют 10 типов этого синдрома), характеризующихся нарушением синтеза коллагена. Так как коллаген присутствует во всех органах и тканях, нарушения при данной патологии являются генерализованными. Они захватывают сердечно-сосудистую, зрительную, дыхательную систему. Ведущим признаком синдрома Элерса-Данлоса являются кожные проявления.
Кожа у таких детей нежная, бархатистая и плохо фиксирована к подлежащим тканям, легко собирается в складки. Она морщинистая на стопах и подошвах. Очень ранимая, особенно после 2 лет. Малейшая травматизация кожи приводит к появлению ран. Такие ранки заживают очень долго, с образованием рубцов и псевдоопухолей.
Несовершенный остеогенез
В данном случае наследственно обусловленная мутация приводит к нарушению формирования костной ткани (остеогенезу). Кости при этой патологии имеют пористое строение, минерализация их нарушена. Вследствие этого, у больных возникают множественные переломы, даже при минимальном механическом воздействии, а в ряде случаев и спонтанные. Таких детей называют «хрустальными».
Прогноз заболевания зависит от типа нарушений остеогенеза. Всего выделяют 4 типа. Наиболее тяжелыми являются 2 и 3 тип генетических аномалий. Продолжительность жизни детей, имеющих несовершенный остеогенез, обычно не превышает нескольких лет. Смерть наступает от последствий множественных переломов и септических (инфекционных) осложнений.
Недифференцированная дисплазия
Недифференцированная дисплазия соединительной ткани у детей – это такая патология соединительной ткани, при которой внешние проявления и клинические симптомы говорят о наличии соединительно-тканного дефекта, но не укладываются ни в один из известных в настоящий момент генетически обусловленных синдромов (синдром Марфана, синдром Элерса-Данлоса, синдром несовершенного остеогенеза и др.).
Ребенок с недифференцированной ДСТ может предъявлять массу неспецифических жалоб: головные боли, быстрая общая утомляемость, боли в животе, неустойчивый стул (чередование запоров и поносов), вздутие живота, плохое зрение. Дети и, особенно, подростки с этой патологией склонны к тревожности, депрессии и ипохондрии. Во взрослой жизни это может привести к снижению социальной адаптации и ограничению социальной активности.
У детей, страдающих ДСТ, часто возникают инфекционные болезни дыхательных путей – от обычного ОРЗ до пневмонии. Поэтому в связи с отсутствием характерных жалоб важно внимательно обратить внимание на внешние симптомы дисплазии соединительной ткани у ребенка.
Артрогрипоз у детей
Со стороны опорно-двигательной системы:
- Гипермобильность суставов.
- Сколиоз.
- Плоскостопие.
- Деформации грудной клетки.
- Непропорционально длинные руки и ноги.
- Различные нарушения прикуса.
Со стороны кожи:
- Гиперэластичность.
- Истонченность.
- Раннее образование морщин.
- Выраженная венозная сеть.
- Склонность к травматизации.
Стрии в области спины – один из частых кожных признаков дисплазии
Со стороны сердечно-сосудистой системы: пролапс митрального клапана, блокада правой ножки пучка Гиса, венозная недостаточность, варикозное расширение вен. Со стороны органов зрения: ангиопатия сетчатки, голубые склеры, миопия. Так называемые малые аномалии скелета: сандалевидная щель на стопе, приросшие мочки ушей, диастема (щель между передними зубами).
Диагностические критерии и принципы терапии
Дисплазия соединительной ткани не представляет сложностей, диагностика проводится легко даже у детей. После клинического осмотра требуется провести генетический анализ и ряд биохимических исследований.
Биохимическая диагностика крови выявляет повышение гликозаминогликанов, которые могут повышаться в моче. В связи со сложностью и высокой стоимостью исследование осуществляется не слишком часто.
Лечебные мероприятия включают компоненты:
- Медикаментозные препараты, которые стимулируют синтез и созревание коллагена – препараты аскорбиновой кислоты, хондроитин, глюкозамин.
- Немедикаментозные средства – массаж, гимнастика, физиопроцедуры. Иглотерапия.
- Сбалансированное питание, богатое коллагеном и витаминами.
Лечение соединительной ткани
Врачи говорят, что, если у человека есть хотя бы 3-5 вышеперечисленных проблем, то это требует серьезного отношения к ситуации и в большинстве случаев регулярной профилактики и поддержания организма, чтобы все органы и системы работали правильно!
Если Вы внимательно до конца посмотрели видео (если не досмотрели, то сделайте это обязательно!), то знаете, что для детей и подростков решением проблем с соединительной тканью являются Белок FAVAO, Клетчатка и сок XANGO. Для взрослых, лучшее решение – это сок КСАНГО и полная система FAVAO, так как организм взрослого человека требует регулярного очищения крови, лимфы и органов, и, чтобы хорошо работали метаболические процессы.
P.S.: врач специалист Микова Вера Сергеевна провела еще одну конференцию по проблемам соединительной ткани, уделив больше внимания костно-суставной системе.
Клиническое наблюдение 2
Пациентка И., 29 лет. Данная беременность вторая. В I триместре скрининговое УЗИ не проводилось. Со слов пациентки при УЗИ, проведенном в 18 нед беременности, возникли подозрения на пузырный занос, в связи с чем консультирована в Российском онкологическом научном центре им. Н.Н. Блохина. Наличие трофобластической болезни не подтверждено. Уровень β-ХГЧ в пределах нормы: 23 335 МЕ/л (10 000-35 000 МЕ/л).
В МОНИИАГ находилась под наблюдением с 20 нед гестации. Данные УЗИ: размеры плода соответствуют 20 нед беременности. Пороки развития и признаки гипотрофии плода не обнаружены. Плацента расположена по передней стенке матки, размерами 145-147 мм, толщиной до 50 мм. Структура плаценты изменена, имеется множество округлых жидкостных включений различного диаметра — от 4 до 12 мм с четкими ровными границами. В структуре плацентарной ткани множественные локусы кровотока. Архитектоника сосудов плаценты не изменена. Кровоток в миометрии сохранен, архитектоника сосудов не изменена. Плодовоплацентарный кровоток не нарушен. Заключение: ультразвуковая картина соответствует МДП (рис. 2-4).
Рис. 2.
Пациентка И. МДП. Диффузное утолщение и множественные кистозные включения в плаценте.
Рис. 3.
Сосудистое дерево при МДП. Архитектоника базальных и спиральных артерий не нарушена.
Рис. 4.
Сосудистое дерево при МДП. Расширенные сосуды стволовых ворсин.
В течение II триместра выявлена сочетанная тромбофилия по гену MTGFR и фактору Leiden. Уровень гомоцистеина в пределах нормы. Маркеров АФС не выявлено.
УЗИ при сроке гестации 36-37 нед: размеры плода соответствуют 36,6 нед беременности. Признаки гипотрофии и пороки развития плода не обнаружены. Плодовоплацентарный кровоток не нарушен. Количество околоплодных вод в пределах нормы. Плацента расположена по передней стенке матки, толщиной до 78 мм, II степени зрелости. Структура плаценты гиперэхогенная, множественные жидкостные включения до 1 см в диаметре, сосуды плаценты расширены. Гормоны фетоплацентарного комплекса в пределах нормы. Уровень ХГЧ — 8 533 МЕ/л (норма 8 880-29 000 МЕ/л).
Самопроизвольные роды произошли в сроке 38 нед. Родилась живая доношенная девочка с массой тела 2710 г, ростом 47 см, что соответствует гипотрофии I степени, без видимых пороков развития, с оценкой состояния по шкале Апгар 8 и 9 баллов. Кровопотеря в родах 300 мл. Послеродовый период протекал без осложнений.
Масса плаценты 1498 г (медиана 445 г), размерами 28 х 27 см, с краевым прикреплением пуповины. Диск толщиной до 7 см, хориальная пластинка с извитыми, резко полнокровными сосудами, крупными очагами субхориального фибриноида. Материнская поверхность с нарушенной целостностью, в краевых отделах кисты с прозрачным содержимым диаметром до 1,5 см. В крае плаценты обширный очаг инфаркта (18 х 9 см), толщина плаценты в этой области не превышает 1 см. На разрезе ткань с многочисленными широкими белесоватыми прослойками, единичными кистами (рис. 5).
Рис. 5.
МДП, макроскопическая картина.
а)
Фрагмент ткани плаценты с пузырьковидными ворсинами.
б)
Крупные извитые сосуды, окруженные желеобразным материалом, кистозные полости, обилие фибриноида.
При микроскопическом исследовании плаценты определяются крупные стволовые ворсины с отечной, рыхлой стромой, местами с образованием полостей (рис. 6). Сосуды в пораженных ворсинах разного диаметра, нередко причудливо извитые. Наблюдаются разнообразные поражения сосудов: облитерационная ангиопатия, тромбоз, нередко с организацией, геморрагический эндоваскулит. Встречаются группы фиброзированных бессосудистых ворсин. Васкуляризация промежуточных и терминальных ворсин неравномерная, местами определяется ангиоматоз. Трофобластическая выстилка без признаков пролиферации. Гистологическое заключение: МДП.
Рис. 6.
МДП, микроскопическая картина.
а)
Резкий отек стволовых ворсин с образованием полостей. х200. Окраска гематоксилином и эозином.
б)
Промежуточные и терминальные ворсины обычного вида рядом с отечной стволовой ворсиной. х100. Окраска гематоксилином и эозином.
в)
Извитой, расширенный сосуд стволовой ворсины. х200. Иммуногистохимическая реакция с антителами к CD31.
г)
Отечная стволовая ворсина с формированием полостей, в сохранной строме видны многочисленные сосуды разного диаметра. х100. Иммуногистохимическая реакция с антителами к CD31.
Клиническое наблюдение 3
Пациентка Ф., 26 лет. Данная беременность первая. В 12 нед при проведении генетического скрининга заподозрены патология хориона?, пузырный занос? Консультирована в медико-генетическом отделении МОНИИАГ: беременность 12 нед 4 дня, аномалия хориона?, частичный пузырный занос?, МДП? При УЗИ в 21 нед гестации: плацента перекрывает внутренний зев с множественными кистозными образованиями. Проводилось обследование на наличие генетических маркеров тромбофилии, выявлена сочетанная тромбофилия по гену MTGFR и PAI — I. Уровень ХГЧ составил 52 624 МЕ/л, α-фетопротеина — 194,0 МЕ/л.
С 25-26 нед гестации выявлена задержка внутриутробного роста плода I степени, асимметричного типа. Плодово-пла центарный кровоток не нарушен. Плацента «0» степени зрелости, толщиной 33 мм (больше нормы), с множественными кистозными образованиями, перекрывает внутренний зев. При исследовании уровня гормонов фетоплацентарного комплекса в 30 нед гестации плацентарный лактоген, прогестерон, кортизол и α-фетопротеин находились в пределах нормативных значений.
При УЗИ в 31 нед значение бипариетального размера соответствует 10-му перцентилю, ДГ ДЖ — 3-му перцентилю, масса плода — 10-му перцентилю, что характерно для задержки внутриутробного роста плода I степени. Плацента по передней стенке матки толщиной до 47-63 мм, III степени зрелости. Особенности строения плаценты: примерно 1/3 плаценты по левому краю со структурными изменениями: множественные жидкостные включения размером до 4-5 мм, кровоток определяется, архитектоника сосудистого дерева не изменена. Прикрепление пуповины к неизмененной части плаценты. Заключение: беременность 31 нед. Головное предлежание. Синдром задержки роста плода I степени. МДП. Умеренное многоводие (рис. 7).
Рис. 7.
Пациентка Ф. МДП. Кистозные включения в структуре утолщенной плаценты.
Течение беременности осложнилось присоединением умеренной преэклампсии. Несмотря на проводимую терапию, отмечено нарастание симптомов преэклампсии, появились нарушения плодовой гемодинамики. При сроке гестации 36 нед пациентка родоразрешена путем кесарева сечения. Извлечена живая недоношенная девочка с массой тела 1950 г, ростом 44 см, что соответствовало задержке внутриутробного роста II степени, гипотрофии II степени. Оценка состояния по шкале Апгар 7 и 8 баллов. Операция протекала без технических сложностей. Кровопотеря составила 800 мл.
Масса плаценты нормальная (409 г при медиане 408 г). Диск толщиной 5-7 см, хориальная пластинка с извитыми, резко полнокровными сосудами, крупными очагами субхориального фибриноида. Материнская поверхность с ненарушенной целостностью, в краевых отделах кисты с прозрачным содержимым диаметром до 1,5 см с изменениями ворсинчатого дерева и выраженными гемореологическими изменениями — некрозом больших групп ворсин и облитерацией фибрином не менее 1/3 объема плацентарного диска. Гистологическое заключение: МДП.
Клиническое наблюдение 4
Пациентка О., 28 лет. Направлена в поликлинику МОНИИАГ с подозрением на частичный пузырный занос. При исследовании в МОНИИАГ размеры плода соответствуют 14-15 нед беременности, маркеров хромосомных аномалий и пороков развития плода не выявлено. Плацента расположена по передней стенке матки толщиной 28 мм.
Выявлены массивные структурные изменения плаценты: множественные жидкостные включения различного диаметра — от 4 до 12 мм, округлые, анэхогенные, с ровными четкими контурами. Кровоток в миометрии выраженный, в структуре плацентарной ткани множественные локусы кровотока, сосуды крупного диаметра, сосудистое дерево, архитектоника сосудов сохранены. Плодовая гемодинамика не нарушена.
Заключение: беременность 13-14 нед. Структурные изменения плаценты — нельзя исключить МДП. Дифференциальная диагностика с пузырным заносом после получения анализа крови на β-ХГЧ (рис. 8, 9).
Рис. 8.
Пациентка О. Структурные изменения плаценты при МДП.
Рис. 9.
Пациентка О. Сосудистая архитектоника при МДП.
Повышение уровня β-ХГЧ послужило основанием для направления пациентки для консультации в центр трофобластической болезни, где она наблюдалась до 33 нед, проводилась дифференциальная диагностика между множественными хорионангиомами плаценты и дистрофическими изменениями в плаценте. Четких данных о наличии трофобластической болезни не было выявлено, несмотря на значительное повышение уровня β-ХГЧ (103 000 ед. при норме до 78 100 ед.).
УЗИ, проведенное в МОНИИАГ в 33 нед: размеры плода соответствуют 31,2 нед беременности. Предполагаемая масса 1800-1900 г. Аномалий развития не выявлено. Размеры и масса плода соответствуют 25-50-му перцентилю для данного срока, задержки внутриутробного роста не выявлено. Плацента по передней стенке матки толщиной от 40 до 52 мм, III степени зрелости. Особенности строения плаценты: в правой части плацента более эхогенная, в структуре единичные анэхогенные участки неправильной формы, кровоток обычный, сосудистая архитектоника не изменена, кровоток в спиральных артериях прослеживается, индекс резистентности (ИР) 0,36, систолодиастолическое отношение (С/Д) 1,57. Ультразвуковая картина данной части плаценты не типична для пузырного заноса, не типична для III степени зрелости, не имеет признаков хорионангиомы. На остальном протяжении плацента утолщена, структура более характерна для III степени зрелости — определяются граница котиледонов, в центре котиледона — анэхогенная зона с гиперэхогенным кольцевидным участком по периферии. Сосудистая архитектоника не изменена, кровоток в спиральных артериях прослеживается, ИР 0,31, С/Д 1,45. Заключение: беременность 33 нед. Головное предлежание. Диффузное утолщение плаценты. Структурные изменения плаценты не типичны для хорионангиомы, не позволяют дифференцировать частичный пузырный занос и мезенхимальную дисплазию.
Родоразрешена при беременности 37 нед, произошли самопроизвольные роды, протекали без осложнений. Родился живой доношенный мальчик с массой тела 2850 г, ростом 47 см, что соответствует гипотрофии плода I степени, оценка по шкале Апгар 8-9 баллов. Течение послеродового периода без осложнений.
Масса плаценты составила 714 г (более 97-го перцентиля, медиана 430 г). Макроско пическое и микроскопическое исследование подтвердило МДП.
Выводы
На основании немногочисленных наблюдений МДП можно сформулировать некоторые положения, касающиеся диагностики и течения беременности при этой редкой патологии.
- Наиболее значимым методом диагностики МДП в настоящее время можно считать лучевые методы, в частности УЗИ. Ультразвуковая картина мезенхимальной дисплазии плаценты достаточно характерна и заключается в диффузном утолщении плаценты, множественных кистозных полостях, занимающих часть плаценты или всю площадь плаценты. Кистозные полости при МДП имеют существенные отличия от частичного пузырного заноса: размеры кист позволяют дифференцировать их в виде отдельных округлых анэхогенных структур с ровными четкими контурами, гладкой внутренней поверхностью. Морфологическая основа кистозных включений в плацентарной ткани — резкий отек стволовых ворсин с образованием полостей. Архитектоника сосудистой сети не нарушена, топография плацентарных сосудов соответствует строению нормальной сосудистой сети плаценты. Извитые, расширенные сосуды стволовых ворсин могут четко определяться при ЦДК.
- При подозрении на частичный пузырный занос и отсутствии аномалий развития плода можно предполагать МДП, возможно пролонгирование беременности. При МДП уровень β-ХГЧ не всегда соответствует норме для данного срока гестации, а уровень α-фетопротеина не всегда имеет высокие значения, следовательно, ни уровень β-ХГЧ, ни уровень α-фетопротеина не играют решающей роли в постановке диагноза.
- Для течения беременности при МДП характерно формирование плацентарной недостаточности, задержки внутриутробного роста плода. Но не только наличие структурных изменений в плаценте определяет формирование осложнений беременности. Ведение беременности, определение сроков и методов родоразрешения должны проводиться по акушерским показаниям с учетом сопутствующей экстрагенитальной и акушерской патологии.
- При удовлетворительном состоянии плода и отсутствии противопоказаний со стороны матери возможно ведение родов через естественные родовые пути. Ни в одном наблюдаемом случае структурные изменения плаценты не привели к нарушению сократительной деятельности матки в родах или послеродовом периоде, кровопотеря не превысила физиологическую.
Литература
- Moscoso G., Jauniaux E., Hustin J. Placental vascular anomaly with diffuse mesenchymal stem villous hyperplasia: a new clinico-pathological entity? // Pathol Res Pract. 1991; 187 (2-3): 324-328.
- Arigita M., Illa M., Nadal A., Badenas C., Soler A., Alsina N., Borrell A. Chorionic villus sampling in the prenatal diagnosis of placental mesenchymal dysplasia // Ultrasound Obstet Gynecol. 2010; 36: 644-646.
- Arizawa M., Nakayama M. Suspected involvement of the X chromosome in placental mesenchymal dysplasia // Congenit Anom (Kyoto). 2002; 42: 309-317.
- Kaiser-Rogers К.A., McFadden D.E., Livasy C.A., Dansereau J., Jiang R., Knops J.F. Androgenetic/ biparental mosaicism causes placental mesenchymal dysplasia // J Med Genet. 2006; 43: 187-192.
- H’mida D., Gribaa M., Yacoubi T. et al. Placental mesenchymal dysplasia with Beck-Wiedemann syndrome fetus in the context of biparental and androgenic cell lines // Placenta. 2008; 29 (5): 454-460.
- Armes J., McGown I., Williams M. et al. The placenta in Beckwith-Wiedemann syndrome: genotype-phenotype associations, excessive extravillous trophoblast and placental mesenchymal dysplasia // Roy Coll Pathol Aust. 2012; 44 (6): 1-9. 7. Aviram R., Kidron D., Silverstein S. Placental mesenchymal dysplasias associated with transient neonatal diabetes mellitus and paternal UPD6 // Placenta. 2008; 29 (7): 646-649.
- Nayeri U.A., West A.B., Grossetta Nardini H.K., Copel J.A., Sfakianaki A.K. Systematic review of sonographic findings of placental mesenchymal dysplasia and subsequent pregnancy outcome // Ultrasound Obstet Gynecol. 2013; 41 (Issue 4): 366-374.
- Hui Li, Lei Li, Xiao Tang, Fan Yang, Kai-Xuan Yang. Placental mesenchymal dysplasia: a case of a normal-appearing fetus with intrauterine growth restriction. Case Report // Int J Clin Exp Pathol. 2014; 7 (8): 5302-5307.
- Павлов К.А., Дубова Е.А., Щеголев А.И. Мезенхимальная дисплазия плаценты // Акушерство и гинекология. 2010. 5: 15-20.